MINISTERIO DE SALUD
SECRETARÍA DE POLÍTICAS, REGULACIÓN E INSTITUTOS
ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
Disposición 6766/2016
Bs. As., 29/06/2016
VISTO la Ley N° 16.463, sus Decretos Reglamentarios N° 9763/64 y .° 150/92 (T.O. Decreto 177/93), la Resolución ex Secretaría de Políticas, Regulación y Relaciones Sanitarias N.° 46/03, las Disposiciones ANMAT N° 5904/96, N° 3185/99 con sus complementarias y modificatorias, N° 3311/01, N° 2807/02, N° 2819/04, N° 5040/06, N° 1746/07, N° 2446/07, N° 556/09, N° 758/09, N° 5743/09, N° 6677/10, N° 3113/10, N° 1263/12, N° 4132/12, N° 4326/12, N° 4788/12, N° 1918/13 y N° 2434/13, el Informe de la Organización Mundial de la Salud N° 992/2015 (Anexo 7), y el Expediente N° 1-47-1110-311-14-0 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica; y
CONSIDERANDO:
Que los estudios de bioequivalencia en humanos han sido aceptados en los últimos 25 años como un requisito sobre el cual se basan las agencias regulatorias de medicamentos para establecer la equivalencia terapéutica de los productos farmacéuticos multifuentes con respecto a un producto de referencia.
Que por Disposición ANMAT N° 3185/99 se aprobaron las recomendaciones técnicas para la realización de estudios de equivalencia contenidas en el documento denominado: “Cronograma para exigencia de estudios de equivalencia entre medicamentos de riesgo sanitario significativo”, y mediante disposiciones posteriores, esta Administración Nacional ha ido incorporando ingredientes farmacéuticos activos a la obligatoriedad de demostración de bioequivalencia.
Que la Organización Mundial de la Salud (OMS) en su Serie de Informes Técnicos N° 937 —Anexo 8— ha considerado al Sistema de Clasificación Biofarmacéutica (SCB) como una herramienta válida de clasificación de aquellos principios activos que solo requieren demostraciones de equivalencia in vitro exceptuándolos de estudios in vivo.
Que el SCB se basa en la solubilidad acuosa y la permeabilidad intestinal del principio activo; cuando estas dos propiedades se combinan con la disolución del medicamento se obtienen los tres factores que determinan la velocidad y la cantidad de principio activo absorbido desde una forma farmacéutica oral de liberación inmediata, permitiendo establecer la inferencia de la Bioequivalencia.
Que de acuerdo a los principios del SCB surgen dos conceptos aplicables a los productos farmacéuticos multifuentes: el de estudios de equivalencia in vitro y el de bioexenciones.
Que la introducción del SCB ha provocado un gran impacto en la práctica regulatoria al establecer las pautas para la demostración de la bioequivalencia entre medicamentos mediante ensayos de disolución in-vitro para las formas farmacéuticas sólidas orales de liberación inmediata, limitando así los requerimientos de estudios in vivo.
Que las agencias de medicamentos de los Estados Unidos (Food and Drug Administration, FDA) y de la Comunidad Económica Europea (European Medicines Agency, EMA) han adoptado los criterios del SCB y ambas coinciden en que la bioexención es justificada cuando las drogas tienen alta solubilidad y alta permeabilidad (Clase I), son de amplio margen terapéutico y el producto cumple con determinados criterios de disolución.
Que la OMS en el documento antes mencionado considera exceptuables de la demostración de equivalencia in vivo a las drogas de Clase I y también extiende la bioexención a los productos medicinales que contengan drogas de Clase III (baja permeabilidad / alta solubilidad), criterio recientemente adoptado por la EMA.
Que la demostración de la bioequivalencia mediante ensayos de disolución, permite reducir en forma considerable los tiempos y costos de la realización de estudios in vivo, reemplazar en algunos casos los estudios en humanos y agilizar la ejecución de las políticas sanitarias vigentes con la finalidad de poner al alcance de la población un número cada vez mayor de productos medicinales con equivalencia establecida.
Que es de interés nacional promover la adopción de lineamientos técnicos para mantener el nivel de fiscalización dentro de los parámetros internacionales.
Que en la Disposición ANMAT N° 758/09 se establecieron los requisitos necesarios para reemplazar los estudios de bioequivalencia in vivo por estudios de disolución basados en el Sistema de Clasificación Biofarmacéutico del IFA.
Que es necesario establecer requisitos para la solicitud de Bioexención, en los casos de: solicitudes de exención de los estudios de biodisponibilidad (BD) y/o bioequivalencia (BE) in vivo para formas farmacéuticas sólidas orales de liberación inmediata (FFSO-LI) en base al Sistema de Clasificación Biofarmacéutico (SCB) y para formulaciones sólidas orales proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro, y para cambios posteriores en formulaciones que hayan demostrado BE.
Que a tales fines es necesario adoptar una Guía que aporte las recomendaciones para su implementación.
Que la aplicación de las normas aludidas tiene como finalidad última la protección de la salud de la población mediante la adopción de un modelo fiscalizador de gestión que destina sus esfuerzos a la verificación continua de la eficacia, seguridad y calidad de los productos que aquélla consume.
Que el Instituto Nacional de Medicamentos y la Dirección General de Asuntos Jurídicos han tomado la intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por el Decreto N° 1490 de fecha 20 de agosto de 1992 y el Decreto N° 101 del 16 de diciembre de 2015.
Por ello,
EL ADMINISTRADOR NACIONAL DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
ARTÍCULO 1° — Las solicitudes de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia deberán efectuarse de acuerdo a la “Guía para la solicitud de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia” que como Anexo forma parte integrante de la presente disposición.
ARTÍCULO 2° — La presente disposición entrará en vigencia a partir del día siguiente a su publicación en el Boletín Oficial.
ARTÍCULO 3° — Regístrese. Dése a la Dirección Nacional del Registro Oficial para su publicación. Notifíquese a las Cámaras de Especialidades Medicinales (CILFA, CAEME, COOPERALA, CAPGEN, CAPEMVEL, SAFYBI), Confederación Médica de la República Argentina (COMRA) y la Confederación Farmacéutica Argentina (COFA). Cumplido, archívese. — Dr. CARLOS CHIALE, Administrador Nacional, A.N.M.A.T.
1. INTRODUCCIÓN
Esta guía aporta recomendaciones para las solicitudes de exención de los estudios de biodisponibilidad (BD) y/o bioequivalencia (BE) in vivo para formas farmacéuticas sólidas orales de liberación inmediata (FFSO-LI) en base al Sistema de Clasificación Biofarmacéutico (SCB)*; para formulaciones sólidas orales proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro; y para cambios posteriores en formulaciones que hayan demostrado BE.
La presente guía describe:
a) brevemente los fundamentos del SCB.
b) cuándo y cómo se pueden solicitar bioexenciones para FFSO-LI.
c) los métodos recomendados para determinar la solubilidad y la permeabilidad de los ingredientes farmacéuticos activos (IFAS en adelante), y la cinética de liberación-disolución in vitro de los productos farmacéuticos de liberación inmediata.
d) la forma de tramitar una solicitud de bioexención y los antecedentes que deben presentarse a la Administración Nacional de Medicamentos Alimentos y Tecnología Médica (ANMAT).
* El SCB considera Productos de Liberación inmediata a aquellos que presentan Patrones de rápida y muy rápida disolución.
2. EL SISTEMA DE CLASIFICACIÓN BIOFARMACÉUTICO
2.1 Descripción y Fundamento Científico:
El SCB es un marco científico para clasificar los ingredientes farmacéuticos activos (IFAS) en base a su solubilidad acuosa y su permeabilidad intestinal. (1-6)
Cuando se combina con la disolución y el análisis crítico de los excipientes del producto farmacéutico oral de liberación inmediata, el SCB toma en cuenta los factores principales que gobiernan la velocidad y extensión de la absorción del IFA desde el producto farmacéutico: la composición de excipientes, la disolución, solubilidad y la permeabilidad intestinal. (7-8)
Según el SCB, los IFAS se clasifican de acuerdo a la siguiente tabla.
Tabla 1: Clasificación de los IFAS en base al Sistema de Clasificación Biofarmancéutico.
2.1.1 Solubilidad
Un IFA se considera altamente soluble cuando la dosis más elevada del producto farmacéutico para la vía oral es soluble en un volumen de 250 ml o menos (dosis / solubilidad = 250 ml) en un medio acuoso y en un intervalo de pH comprendido entre 1,2 y 6,8 a 37 ± 1°C. Por ejemplo, si un IFA se encuentra en forma de comprimidos de 500 mg, 850 mg y 1000 mg, ese IFA se considera altamente soluble cuando la dosis más elevada (1000 mg) se disuelve en las condiciones anteriormente citadas. (9-10)
2.1.2 Permeabilidad
Se considera que un IFA es altamente permeable cuando se establece que la fracción absorbida de la dosis administrada en seres humanos es del 85% o más, basándose en una determinación de balance de masa o en la comparación con una dosis de referencia intravenosa. (11)
2.1.3 Cinética de disolución de las FFSO-LI
A los fines de una solicitud de bioexención, se considera que un producto farmacéutico es de muy rápida disolución cuando 85% o más de la cantidad declarada se disuelve dentro de los 15 minutos en un medio de disolución de pH 1,2; 4,5 y 6,8 a 37°C usando el aparato II —paleta— de la Farmacopea Argentina, 7° Ed. Vol 1 (Aparato II.FA.7ma) a 75 rpm o alternativamente el aparato I —canastillo— de la Farmacopea Argentina, 7° Ed. Vol 1 (Aparato I.FA.7ma) a 100 rpm.
Se considera que un producto farmacéutico es de rápida disolución cuando más del 85% de la cantidad declarada se disuelve dentro de los 30 minutos en las mismas condiciones mencionadas anteriormente.
Podrá solicitarse la bioexención para productos farmacéuticos conteniendo IFAS de Clase I si los dos productos a comparar, referencia y multifuente, pueden ser categorizados como de disolución muy rápida o, cuando siendo de disolución rápida sus perfiles de disolución resultan esencialmente similares.
Para productos farmacéuticos conteniendo IFAS de Clase III, en cambio, la bioexención sólo podrá ser solicitada si los dos productos a comparar, referencia y multifuente, pueden ser categorizados como de disolución muy rápida.
2.2 Antecedentes internacionales de las Bioexenciones:
Agencias Regulatorias
La tabla 2 muestra las diferencias, actualmente existentes, entre las clases bioexceptuables para las distintas agencias regulatorias y organizaciones de salud.
Tabla 2: Clases de IFAS bioexceptuables, según diferentes agencias regulatorias y organizaciones de salud.
(EMA: Agencia Europea de Medicamentos; FDA: Agencia de Medicamentos de Estados Unidos de América; OMS: Organización Mundial de la Salud)
2.3 Ámbito de aplicación de las Bioexenciones en Argentina:
El método del SCB descrito en esta guía puede emplearse solamente para justificar las bioexenciones de los productos farmacéuticos fabricados conforme a las Buenas Prácticas de Fabricación y Control de Medicamentos.
La aplicación de estas exenciones se ha considerado para:
a) Formas farmacéuticas sólidas orales de liberación inmediata que contienen IFAS pertenecientes a la clase I y/o III.
b) Formulaciones proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro.
c) Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado BE.
3. APLICACIÓN DE BIOEXENCIONES
3.1 Bioexenciones basadas en el SCB
3.1.1 Metodología para clasificar los IFAS en base a su solubilidad, permeabilidad y determinación de las características cinéticas de disolución de los productos multifuente.
3.1.1.1 Clasificación en base a la solubilidad de los IFAS
Uno de los objetivos del SCB es determinar la solubilidad en equilibrio de un IFA bajo condiciones fisiológicas de pH, para lo cual se deberá determinar la solubilidad en función del pH del IFA en estudio, en un medio acuoso a 37±1°C en tres pH comprendidos entre 1,2-6,8 durante 24 horas. Además, se deberá evaluar un número suficiente de condiciones de pH para definir con precisión el perfil de solubilidad versus pH.
Para la determinación de la solubilidad, resulta conveniente seleccionar las condiciones de pH considerando las características de ionización del IFA en estudio. Por ejemplo, cuando su pKa se encuentra entre 3-5, determinar la solubilidad a pH = pKa; pH = pKa+1; pH = pKa-1, y a pH = 1,2 y 6,8. Se recomienda un mínimo de tres mediciones de solubilidad en cada condición de pH debiendo ser el CV% menor que 5% (CV% = [desvío estándar / media aritmética]*100). Según la variabilidad del estudio, es posible que sea necesario un mayor número de determinaciones para proveer un cálculo de solubilidad confiable. Si el número de muestras es mayor que 3, todas las réplicas deben ser consideradas en el cálculo del desvío estándar.
Para ser utilizadas en los estudios de solubilidad, se consideran apropiadas las soluciones reguladoras estándares descritas en la Farmacopea Argentina Ed. 7° o en el capítulo Reactivos, Indicadores y Soluciones de la Farmacopea de Estados Unidos.(12-13) Si estas soluciones no resultaran apropiadas por razones físicas o químicas, se tendrán que utilizar otras soluciones reguladoras justificando su uso. Se deberá verificar el pH de la solución antes y después de agregar el IFA a la solución reguladora.
Utilizar el método tradicional de agitación en matraz u otros métodos con justificación que avale la capacidad de los mismos de medir la solubilidad en equilibrio del IFA en estudio.
Se deberá determinar la concentración del IFA en las soluciones reguladoras seleccionadas, en las condiciones de pH señaladas, empleando un ensayo validado que indique la estabilidad y que pueda diferenciar el IFA de sus productos de degradación si los hubiere (p. ej., cuantificación por HPLC). (14) Si se observa la degradación del IFA en función de la composición de la solución reguladora y/o del pH, se deberá comunicar el hecho junto con los demás datos de estabilidad recomendados en esta guía. La estabilidad del IFA se evaluará en todas las condiciones experimentales considerando la duración total del estudio (comparación con el valor nominal, en un mínimo de tres repeticiones).
Complementariamente, se deberá establecer la clasificación de solubilidad, calculando el volumen de un medio acuoso suficiente para disolver la mayor concentración posológica de la forma farmacéutica en la gama de pH de 1,2-6,8. De esta forma, se clasificará un IFA como altamente soluble cuando la mayor dosis sea soluble en un volumen = 250 mL de medio acuoso en toda la gama de pH comprendida entre 1,2-6,8. (15-16)
3.1.1.2 Clasificación en base a la permeabilidad de los IFAS
Se puede establecer o referenciar la clasificación de la permeabilidad de un IFA en sujetos humanos empleando los métodos de balance de masa, de BD absoluta o de perfusión intestinal.
Los métodos recomendados que no involucran a sujetos humanos, incluyen la perfusión intestinal in vivo o in situ en un modelo animal apropiado (p. ej., ratas) y/o métodos de permeabilidad in vitro, empleando tejidos intestinales extirpados o monocapas de células epiteliales apropiadas (p. ej., monocapas de células Caco- 2).
Podrá ser suficiente un solo método cuando la BD absoluta es del 85% o más, o cuando se recupera en la orina el 85% o más, del IFA administrado.
Si un sólo método no demuestra en forma concluyente la clasificación de permeabilidad, se deben emplear dos métodos diferentes.
La estructura química y/o ciertos atributos fisicoquímicos de un IFA (p. ej., el coeficiente de partición en sistemas apropiados) pueden proveer información preliminar útil acerca de sus características de permeabilidad (método in sílico). (3) En ciertos casos, los laboratorios pueden considerar el uso de tal información como antecedente adicional de una clasificación determinada por estudios más robustos como los realizados en humanos.
3.1.1.2.1 Estudios farmacocinéticos en el hombre
• Estudios de balance de masa
Para documentar la medida de absorción de un IFA, es posible usar estudios farmacocinéticos de balance de masa que utilizan isótopos estables o un IFA marcado radioactivamente. Sin embargo, debido a que este método puede proveer cálculos altamente variables de la absorción para muchos IFAS, no representa un método de elección, recomendándose emplear otros métodos.
• Estudios de biodisponibilidad absoluta
Se puede utilizar la determinación de la BD oral usando la administración intravenosa como referencia. Según la variabilidad de los estudios, se deberá incluir un número suficiente de sujetos para proveer un cálculo confiable de la tasa de absorción. Cuando se muestra que la BD absoluta de un IFA es del 85% o más, no hacen falta datos adicionales para documentar la estabilidad del IFA en el fluido gastrointestinal.
3.1.1.2.2 Métodos de permeabilidad intestinal
Se pueden utilizar los siguientes métodos para determinar la permeabilidad de un IFA en el sistema gastrointestinal:
(1) estudios de perfusión intestinal in vivo en seres humanos;
(2) estudios de perfusión intestinal in vivo o in situ en modelos animales apropiados;
(3) estudios de permeabilidad in vitro en tejidos intestinales extirpados humanos o animales;
(4) estudios de permeabilidad in vitro en monocapas de células epiteliales.
Para IFAS transportados pasivamente resultan adecuados los modelos animales in vivo o in situ, y los métodos in vitro como los que usan monocapas de células epiteliales animales o células humanas cultivadas.
La baja permeabilidad de algunos IFAS observada en el hombre podría ser resultado de la expulsión de los IFAS por transportadores de membranas como la glicoproteína de eflujo-P (P-gp). Cuando dichos transportadores están ausentes en los modelos, o su grado de expresión es bajo en comparación con el del hombre, puede haber una mayor probabilidad de error en la clasificación de permeabilidad para un IFA sustrato de los transportadores, en comparación con un IFA transportado en forma pasiva. Por lo tanto, deberá caracterizarse la expresión de transportadores conocidos en los modelos seleccionados. Se puede demostrar la expresión funcional de los sistemas de transporte (p. ej., P-gp), empleando IFAS modelos seleccionados o sustancias químicas sustrato de éstos en concentraciones que no saturen el sistema de transporte (p. ej., ciclosporina A, vinblastina, rodamina 123), mediante técnicas como estudios de transporte bidireccional, que muestran una mayor velocidad de transporte en el sentido basolateral-apical en comparación con el sentido apical-basolateral.
Esta guía recomienda limitar el uso de métodos de prueba de permeabilidad no humanos para los IFAS transportados por mecanismos pasivos. Para aplicar el SCB, se puede suponer un transporte pasivo aparente, cuando se satisface una de las siguientes condiciones:
• En el hombre se demuestra una relación lineal (farmacocinética) entre la dosis (p. ej., en una variedad posológica clínica relevante) y mediciones de área bajo la curva (área debajo de la curva de concentración versus tiempo).
• En un modelo animal se demuestra la falta de dependencia de la permeabilidad respecto de la concentración inicial del IFA (p. ej., 0,01; 0,1 y 1 vez la mayor concentración posológica disuelta en 250 mL), medida en el fluido de perfusión in vivo o in situ.
• En un método de cultivo de células in vitro apropiado, cuya expresión de proteínas transportadoras es conocido (p. ej., P-gp), se demuestra la falta de dependencia de la permeabilidad medida in vitro, respecto de la concentración inicial del IFA (p. ej., 0,01; 0,1 y 1 vez la mayor concentración posológica disuelta en 250 mL) en el fluido donante y respecto del sentido de transporte (p. ej., no existe una diferencia estadísticamente significativa entre la velocidad de transporte cuando se mide en el sentido apical-basolateral y cuando se mide en el sentido basolateral-apical, para las concentraciones del IFA estudiadas).
Para demostrar la aptitud de un método de permeabilidad determinado previsto para la aplicación del SCB, se deberá establecer una relación categoría-orden entre los valores de permeabilidad y los datos de absorción del IFA en sujetos humanos, empleando un número suficiente de IFAS-modelo. Se recomiendan 3 IFAS-modelo para los estudios de perfusión intestinal in vivo en el hombre y 15 IFAS modelo, para los estudios de perfusión intestinal in vivo o in situ en animales y para métodos de cultivo de células in vitro. Según la variabilidad del estudio, se deberá usar un número estadísticamente apropiado de sujetos, animales, muestras de tejidos extirpados o monocapas de células, para proporcionar un cálculo confiable de la permeabilidad del IFA. La relación categoría-orden debe permitir la diferenciación entre los IFA con atributos de permeabilidad intestinal Baja, Moderada y Alta. (7) La adecuabilidad del método para la determinación de la permeabilidad, podrá demostrarse mediante la utilización de IFAS modelo seleccionados a partir de su tasa de absorción baja (< 50%), moderada (50 - 85%) y alta (= 85%). En cada caso deberá existir un número equitativo de IFAS entre las tres categorías. Los patrocinadores podrán seleccionar compuestos de la lista de IFAS y/o sustancias químicas para los cuales exista información disponible respecto del mecanismo de absorción, así como también datos confiables de la cantidad de la absorción del IFA en el hombre.
Después de demostrar la aptitud de un método y mantener el mismo protocolo de estudio, no es necesario ensayar nuevamente todos los IFAS modelo seleccionados para los estudios posteriores que tengan como propósito clasificar un IFA. En lugar de ello, se deberá emplear un IFA modelo de baja permeabilidad y un IFA modelo de alta permeabilidad como patrones internos (incluidos en el fluido de perfusión o en el fluido donante, junto con el IFA que se está estudiando). Estos dos patrones internos se suman al marcador de volumen de fluido o de un compuesto de permeabilidad cero como p. ej., PEG 4000, el cuál se incluye en ciertos tipos de técnicas de perfusión (p. ej., técnicas de lazo cerrado). La selección de patrones internos deberá basarse en la compatibilidad con el IFA en estudio (esto significa que no deberán presentar ninguna interacción física, química o de permeabilidad significativa). Cuando no sea factible cumplir este protocolo, se deberá determinar la permeabilidad de los patrones internos del mismo modo como se realiza la evaluación de permeabilidad del IFA en estudio, en un ensayo paralelo, sobre los mismos sujetos, animales, tejidos o monocapas celulares. Los valores de permeabilidad de los dos patrones internos no deberán diferir significativamente en las distintas pruebas, incluyendo las que se realizan para demostrar la aptitud del método. Al final de una prueba in situ o in vitro, se recomienda determinar la cantidad de IFA en la membrana.
Para un método de prueba determinado, en condiciones experimentales fijas, es posible que el empleo de un patrón interno de alta permeabilidad o cercano al límite del tipo de permeabilidad baja/alta (p. ej., metoprolol), facilite la clasificación del IFA en estudio. Por ejemplo, se podrá determinar que el IFA en estudio es altamente permeable cuando su valor de permeabilidad sea igual o mayor que el metoprolol (IFA punto de corte).
3.1.1.2.3 Inestabilidad en el sistema gastrointestinal
Algunos métodos empleados para determinar la cantidad absorbida de un IFA no tienen en cuenta el alcance de su degradación intestinal, antes de ingresar a la membrana del intestino. Como ejemplo podemos citar: estudios en humanos (balance de masa) que se basan en determinar la radioactividad total del IFA administrado, una vez que llega a la orina; estudios de permeabilidad que se basan en la pérdida o la depuración (clearence) del IFA desde los fluidos introducidos por perfusión en el sistema gastrointestinal humano y/o animal ya sea in vivo o in situ.
Además de los procesos de degradación, la pérdida del IFA desde el sistema gastrointestinal puede producirse por la retención del mismo en la membrana intestinal.
Por lo expuesto, para establecer con certeza la permeabilidad de un IFA, es necesario tener en cuenta los hechos arriba mencionados.
Se deberá documentar la estabilidad del IFA en el sistema gastrointestinal usando fluidos gastrointestinales de modelos animales apropiados y/o fluidos simulados como los Fluidos Gástrico e Intestinal USP a menos que sea posible disponer de fluidos gástricos e intestinales obtenidos de sujetos humanos.
Se deberán incubar los productos farmacéuticos en estos fluidos a 37°C durante un período que sea representativo del contacto del IFA in vivo con estos fluidos; por ejemplo, 1 hora en fluido gástrico y 3 horas en fluido intestinal. Luego se deberán determinar las concentraciones del IFA usando un método analítico validado que indique la estabilidad. Una degradación significativa (> 5%) del IFA en este estudio podría sugerir una posible inestabilidad.
3.1.2 Metodología para determinar las características cinéticas de disolución de los productos multifuente en estudio.
Para la bioexención de un estudio de BE basado en el SCB, tanto el producto multifuente como el producto comparador de referencia, deben exhibir características de disolución in vitro muy rápidas o rápidas, dependiendo de la clase SCB a la que pertenezca el IFA. Adicionalmente, podrá ser requerido que ambos productos presenten similares perfiles de disolución.
3.1.2.1 Demostración de Muy Rápida Cinética de Disolución.
Se debe demostrar que el producto multifuente y el producto comparador de referencia liberan una cantidad = 85% del IFA respecto del valor declarado a los 15 minutos, empleando el Aparato II.FA.7ma a 75 rpm o el Aparato I.FA.7ma a 100 rpm, en un volumen de 900 mL o menos, en cada uno de los siguientes medios:
(1) Solución reguladora de pH 1,2;
(2) Solución reguladora de Acetato a pH 4,5 y
(3) Solución reguladora de Fosfato a pH 6,8.
También son aceptables soluciones reguladoras alternativas con el mismo pH y capacidad buffer, siempre y cuando se demuestre que éstos no afectan algunas de las propiedades fisicoquímicas del medio (p. ej., fuerza iónica) que puedan alterar la cinética de disolución del IFA desde el producto.
3.1.2.2 Demostración de Rápida Cinética de Disolución
Se debe demostrar que el producto multifuente y el producto comparador de referencia liberan una cantidad = 85% del IFA respecto del valor declarado a los 30 minutos, empleando el Aparato II.FA.7ma a 75 rpm o el Aparato I.FA.7ma a 100 rpm, en un volumen de 900 mL o menos, en cada uno de los tres medios mencionados en el punto 3.1.2.1.
3.1.3 Productos a utilizar en el estudio
En un estudio de equivalencia basado en el SCB la diferencia en el contenido del IFA entre producto multifuente y el producto comparador de referencia no debe ser mayor a +/- 5 (Farmacopea Argentina 7ma edición, capítulo <740>)
3.1.3.1 Producto de referencia
El producto de referencia seleccionado deberá ajustarse a los requisitos estipulados en la Disposición ANMAT N° 1918/13 o la/s que en el futuro la complemente o modifique. El lote presentado deberá tener, al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento.
3.1.3.2 Producto multifuente
El laboratorio titular deberá presentar tres lotes independientemente elaborados. Los mismos deben ser iguales a aquellos a comercializarse, en cuanto a fórmula cuali-cuantitativa, calidad de las materias primas, envase primario, método de elaboración, sitio de elaboración, equipos empleados en la elaboración, y método analítico. El tamaño de los lotes y la validación de los procesos productivos deben ajustarse a lo establecido en la Disposición ANMAT N° 1263/12 (o la/s que en el futuro la complemente o modifique), y estar elaborados bajo las Buenas Prácticas de Fabricación y Control vigentes.
3.2 Bioexenciones basadas en formulaciones proporcionalmente similares
3.2.1 Definición de Formulaciones Proporcionalmente Similares
A los fines de solicitar la bioexención, las formulaciones proporcionalmente similares deben ser manufacturadas en el mismo sitio de elaboración y con los mismos procesos que el producto que haya demostrado bioequivalencia/equivalencia in vitro basado en el SCB.
Para las solicitudes de bioexenciones por proporcionalidad, la composición de la/las dosis, deberán ser proporcionalmente similares al producto que haya demostrado BE.
Dos formulaciones proporcionalmente similares pueden ser definidas de dos formas complementarias:
a) Todos los ingredientes de la formulación están exactamente en las mismas proporciones en las diferentes dosis (p. ej., un comprimido de 50 mg de potencia y que posee una cantidad de ingredientes inactivos que es exactamente la mitad de los ingredientes inactivos que posee un comprimido de 100 mg, y el doble de los de un comprimido de 25 mg).
b) En casos donde la cantidad del IFA en el producto es relativamente baja (hasta 10 mg por unidad o no más del 5% del peso total de esa forma farmacéutica). El peso total de la forma farmacéutica se mantiene prácticamente igual para todas las dosis (dentro de ± 10% del peso total), empleando los mismos ingredientes inactivos.
En el caso b) una bioexención por proporcionalidad podrá ser considerada cuando:
- Las cantidades de los diferentes excipientes son los mismos para las distintas dosis consideradas y sólo la cantidad del IFA ha cambiado.
- La cantidad de relleno se ha modificado, como consecuencia del cambio en la cantidad de IFA y las cantidades de los otros excipientes son las mismas para las distintas dosis consideradas.
3.2.2 Bioexención por proporcionalidad según la forma farmacéutica
3.2.2.1 Comprimidos o cápsulas de liberación inmediata
La bioexención de las diferentes dosis de un producto multifuente puede ser considerada cuando:
(I) Las composiciones de las distintas dosis son cuantitativas proporcionales.
(II) Se ha establecido la bioequivalencia/equivalencia in vitro según corresponda para una de las dosis, contra el producto de referencia. Generalmente la dosis estudiada es la mayor, a menos que, por una razón de seguridad se haya establecido la bioequivalencia con una dosis menor o que el IFA sea altamente soluble y posea farmacocinética lineal.
(III) Los perfiles de disolución de la dosis de referencia y la dosis a aprobar, son similares en los tres medios especificados anteriormente y en el medio de control de calidad. En caso de liberarse más de 85% a los 15 minutos, no es necesaria la comparación de perfiles mediante el factor de similaridad (f2).
Si al comparar las distintas dosis se ve afectada la condición sink, se deberá utilizar como producto comparador al producto de referencia utilizado en los estudios de bioequivalencia de igual dosis que el producto multifuente.
Cuando el producto multifuente ha demostrado equivalencia con el producto de referencia basándose en el SCB, la/s nueva/s dosis proporcionales deberán demostrar equivalencia con el producto comparador de referencia de igual dosis.
3.2.2.2 Comprimidos o cápsulas de liberación retardada
Para comprimidos de liberación retardada, cuando el producto está en igual forma farmacéutica, las distintas dosis poseen el mismo mecanismo de liberación, los mismos ingredientes y su composición cuantitativa es proporcionalmente similar, una dosis menor a la dosis con bioequivalencia in vivo aprobada puede ser exceptuada de presentar un estudio de bioequivalencia si tiene un perfil de disolución similar (f2=50) en las condiciones usuales para formas farmacéuticas de liberación retardada (2 horas en medio ácido, seguido de disolución en solución reguladora de pH 6.8).
Al evaluar la proporcionalidad en la composición, se recomienda considerar la proporcionalidad del recubrimiento gastroresistente con respecto a la superficie del comprimido (no del peso del núcleo) para tener el mismo grado de gastrorresistencia (mg/cm2).
En el caso de cápsulas, cuando la diferencia de las dosis es la consecuencia de una disminución en la cantidad de gránulos gastroresistentes que contienen el IFA, la similaridad (f2=50) entre el perfil de disolución de la nueva dosis (menor) y la dosis con bioequivalencia aprobada, en las condiciones usuales de disolución para formas farmacéuticas de liberación retardada, será suficiente para sustentar una bioexención.
3.2.2.3 Cápsulas de liberación prolongada
Para cápsulas de liberación prolongada, cuando la diferencia de dosis es la consecuencia únicamente de una disminución en la cantidad de gránulos que contienen el IFA, la similaridad (f2=50) entre el perfil de disolución de la nueva dosis (menor) y la dosis con bioequivalencia aprobada, realizada en las condiciones de disolución aprobadas para el producto terminado, será suficiente para sustentar una bioexención.
3.2.2.4 Comprimidos de liberación prolongada
Cuando la dosis menor tiene los mismos ingredientes, su composición cuantitativa es proporcionalmente similar, y tiene el mismo mecanismo de liberación, podrá justificarse una bioexención si demuestra similaridad con la dosis con bioequivalencia aprobada, en los perfiles de disolución (f2=50) de por lo menos tres medios de disolución diferentes, de pH entre 1.2 y 7.5 y el medio Cuando la dosis menor tiene los mismos ingredientes, su composición de control de calidad.
3.2.2.5 Farmacocinética lineal
En todos los casos, el solicitante de la Bioexención deberá demostrar o referenciar, además de la proporcionalidad entre las formulaciones, que el IFA posee farmacocinética lineal en el rango de concentraciones terapéuticas. En el contexto de esta guía, se considera farmacocinética lineal cuando un incremento de la dosis resulta en un incremento proporcional del área bajo la curva (AUC). En caso de IFAS con farmacocinética no lineal la sensibilidad del método de disolución puede no ser suficiente para detectar diferencias entre las distintas dosis.
3.2.3 Productos a utilizar en el estudio
Dependiendo del rango terapéutico del IFA, se deberá usar al menos un lote para IFAs de amplio rango terapéutico y al menos dos lotes para IFAS de estrecho margen terapéutico.
3.2.3.1 Producto de referencia
Es el producto cuya titularidad pertenece al mismo laboratorio; generalmente el de dosis más alta que el que se presenta para aprobar, y para el cual la ANMAT ha aceptado la demostración de bioequivalencia con el producto de referencia establecido. En caso que la equivalencia (generalmente el de dosis más alta) haya sido demostrada mediante ensayos in vitro se empleará el producto de referencia, de igual dosis que el producto multifuente, que se ajuste a los requisitos estipulados en la Disposición ANMAT N° 1918/13 o la/s que en el futuro la complemente o modifique.
Deberá tener al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento. Es recomendable la presentación de resultados de valoración y cinética de disolución de más de un único lote del producto de referencia.
3.2.3.2 Producto multifuente
En la solicitud de bioexención, el laboratorio titular deberá presentar lote/s elaborado/s bajo las Buenas Prácticas de Fabricación y Control (Disposición ANMAT N° 2819/2004 o la/s que en un futuro la complemente o modifique).
El tamaño de los lotes y la validación de los procesos productivos deben ajustarse a lo establecido en la Disposición ANMAT N° 1263/12 (o la/s que en un futuro la complemente o modifique).
3.3 Bioexenciones para cambios posteriores a demostración de bioequivalencia
Ciertos cambios menores en la elaboración, de formas farmacéuticas sólidas orales de liberación inmediata, pueden ser autorizados sin riesgo de bioinequivalencia con el biolote, según se establece en la Disposición ANMAT N° 556/09.
3.3.1 Productos a analizar en el estudio
3.3.1.1 Producto de referencia
El lote del producto de referencia presentado deberá tener, al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento. Es recomendable la presentación de resultados de valoración y cinética de disolución de más de un único lote del producto de referencia. (17)
3.3.1.2 Producto multifuente en estudio
El producto elaborado en las condiciones y/o composición propuestas. El número de lotes dependerá del nivel de cambio aprobado.
4. CONSIDERACIONES ADICIONALES PARA SOLICITAR UNA BIOEXENCIÓN
Cuando se solicita una bioexención basándose en el SCB para los estudios de BD/BE in vivo de FFSO-LI, los solicitantes deberán tener en consideración las siguientes situaciones particulares que pueden afectar su solicitud o la documentación que deberán adjuntar a ésta:
4.1 Excipientes
Algunos excipientes pueden afectar la velocidad y la cantidad de IFA absorbido. Para respaldar una solicitud de bioexención la cantidad de excipientes en el producto farmacéutico de liberación inmediata deberá corresponder a la función prevista (p. ej., lubricantes).
Se deberá establecer la adecuabilidad de los excipientes aportando documentación correspondiente a cualquiera de las siguientes alternativas:
1- El/los excipiente/s están presentes en cantidades similares en el Producto Comparador de Referencia.
2- El /los excipientes están presentes en cantidades similares en productos que contienen el mismo principio activo y poseen autorización de comercialización en países miembros de ICH.
3- El /los excipientes están presentes en el producto en cantidades normalmente empleadas para esa forma farmacéutica. Consultar en el sitio: www.accessdata.fda.gov/scripts/cder/iig/index.cfm de la FDA para búsqueda de ingredientes inactivos utilizados en productos aprobados.
Cuando se incluyen excipientes nuevos o cantidades atípicamente grandes de excipientes de uso común en una forma farmacéutica sólida de liberación inmediata (p. ej., agentes tensoactivos), la ANMAT podrá pedir información adicional que documente la ausencia de un posible impacto sobre la BD del IFA. En determinadas ocasiones, tal información puede proporcionarse con un estudio de BD relativa usando una solución acuosa simple como producto de referencia.
Ciertos excipientes en cantidades inusuales, como surfactantes (p. ej., polisorbato 80) y edulcorantes (p. ej., manitol o sorbitol), podrían ser cuestionables al provocar un posible impacto sobre la BD de IFA. Para las formulaciones que contengan algún/os de estos excipiente/s deben ser cualitativamente los mismos y cuantitativamente similares a aquellos del producto de referencia. (18)
Para formulaciones que solicitan bioexención por proporcionalidad de dosis, la información sobre excipientes, se complementa en el punto 3.2.1 de la presente guía.
Para formulaciones basadas en el SCB que contengan IFAS de clase I, podrá permitise cierta flexibilidad en los excipientes empleados con excepción de los excipientes críticos mencionados anteriormente. (18-20)
Para formulaciones que contengan IFAS de clase III, los excipientes debe/n ser cualitativamente los mismos y cuantitativamente similares a aquellos del producto de referencia. (18-20)
La cantidad relativa de excipientes en dos formas sólidas orales se considera cuantitativamente similar si las diferencia en las cantidades de excipientes se encuentran dentro de los límites descriptos en la tabla 3.
Tabla 3: Diferencia aceptable, expresada como porcentaje (p/p) de la formulación total del producto, para que los excipientes de dos formas farmacéuticas sean considerados cuantitativamente similares.

4.2 Profármacos
La permeabilidad de los profármacos dependerá del mecanismo y del sitio (anatómico) de su conversión en el fármaco propiamente dicho. Cuando se demuestra que la conversión de profármaco en fármaco ocurre predominantemente después del pasaje de la membrana intestinal, se deberá medir la permeabilidad del profármaco. Cuando esta conversión ocurre antes del pasaje de la membrana intestinal, se deberá determinar la permeabilidad del fármaco. Los datos sobre la disolución, así como también de solubilidad en función del pH, para el profármaco pueden ser relevantes. Para optar a una bioexención, los patrocinadores podrían considerar conveniente consultar con el personal de la agencia regulatoria, antes de solicitar el empleo del método del SCB para productos de liberación inmediata que contienen profármacos.
4.3 Situaciones en las que no aplican las bioexenciones
Las bioexenciones en base al SCB no son aplicables para los siguientes productos farmacéuticos:
4.3.1 Productos de estrecho margen terapéutico
Esta guía define a los productos de estrecho margen terapéutico como aquellos que contienen ciertos IFAS que están sujetos a control de la concentración de IFA (monitoreo terapéutico) o a monitoreo farmacodinámico, y/o donde la información científica farmacológica disponible del IFA indica que presenta estrecho margen terapéutico. Los ejemplos incluyen: digoxina, litio, fenitoína, teofilina y warfarina. Ya que no siempre todos los IFAS que están sujetos a monitoreo terapéutico o a monitoreo farmacodinámico son IFAS de productos de estrecho margen terapéutico, en algunas situaciones los patrocinadores deberán contactarse con la agencia regulatoria, para determinar si se debe considerar que un determinado IFA corresponde efectivamente a uno de estrecho margen terapéutico.
4.3.2. Productos diseñados para ser absorbidos en la cavidad oral
Para formas farmacéuticas diseñadas para absorción en la cavidad oral (p. ej., comprimidos sublinguales o bucales), no es apropiada una solicitud de bioexención de estudios de BD/BE in vivo en base al SCB.
5- CONDICIONES EXPERIMENTALES DE LOS ESTUDIOS CINÉTICOS COMPARATIVOS DE DISOLUCIÓN PARA DEMOSTRAR EQUIVALENCIA.
5.1 Equipos y Procedimientos
Los ensayos de disolución deben realizarse en el aparato de paletas, (Aparato II.FA.7ma), a 75 rpm o en el aparato de canastillo (Aparato I.FA.7ma) a 100 rpm, en un volumen de 900 mL o menos, en los tres medios de disolución mencionados en 3.1.2.1. Los medios de disolución deben desgasificarse inmediatamente antes de comenzar el ensayo, filtrando cada medio al vacío y calentado previamente a 41°C, utilizando un filtro de membrana de 0,45 µm con agitación vigorosa. Puede emplearse otra metodología de desgasificado, adecuadamente validada.
Los equipos y procedimientos generales deberán estar de acuerdo con lo establecido en la Farmacopea Argentina o la USP edición vigente, así como con las siguientes recomendaciones:
a) No resulta admisible el comienzo escalonado del ensayo de disolución.
b) En el aparato de paletas, las unidades deben ser introducidas en cada vaso con el equipo detenido e inmediatamente después comenzar la agitación. En el aparato de canastillo, las muestras deben colocarse en los cestillos perfectamente secos, introducir los cestillos en los vasos, e inmediatamente después iniciar la agitación.
c) La extracción de las muestras puede realizarse en modo manual o automático. Si es manual, deberá usarse una jeringa con cánula de acero provisto de un filtro de tamaño de poro de entre 0.45 y 0.70 µm que puede estar ubicado en el extremo de la cánula o en su unión con la jeringa. Debe tenerse en cuenta la tolerancia máxima admitida en el tiempo de muestreo entre el primer vaso y el último. El rango admitido del tiempo de muestreo es ± 2% resultando, p. ej., para el muestreo a los 10 minutos (600 segundos), una diferencia entre el primer y último vaso de 12 segundos. Si no es posible la toma de muestra dentro de este margen de tolerancia, deberá usarse muestreo automático. En este caso deberá validarse la ausencia de interferencia del muestreo automático en los resultados.
d) No son admisibles para el filtrado de las muestras el filtrado por papel ni centrifugación.
Para calificar al equipo de disolución se recomienda realizar:
-Calibración mecánica: Con una antelación no mayor a seis meses de realizar los estudios comparativos de disolución, se recomienda verificar los siguientes parámetros críticos del equipo de disolución: horizontalidad, centrado y vaivén de los ejes, vaivén del canastillo, fluctuaciones de temperatura, velocidad de rotación de los ejes y altura del canastillo. Los límites aceptables son los establecidos en la USP vigente.
-Calibración química: Se recomienda emplear los comprimidos USP Prednisone tablets RS, ajustándose a las especificaciones establecidas para el lote vigente.
5.2 Validación del método analítico empleado en el estudio de disolución
Para que los resultados experimentales sean confiables, los métodos utilizados deberán ser apropiadamente validados. Se entiende por validación, al proceso mediante el cual se demuestra la aplicabilidad de un método analítico y consiste en el establecimiento de una evidencia documentada que demuestre con alto grado de probabilidad que el método es confiable para producir el resultado previsto dentro de los intervalos definidos. (19)
Los parámetros recomendados para la validación del método analítico utilizado son: linealidad, exactitud, precisión y robustez. Además se recomienda documentar la especificidad del método, la influencia del muestreo automático y del sistema de filtración de las muestras extraídas desde los vasos de disolución, la estabilidad del analito en las soluciones, la precisión intermedia y los límites de cuantificación y detección del analito. (19)
5.2.1 Especificidad
Es la capacidad de un método de cuantificar el analito en presencia de otros componentes que puedan estar presentes (impurezas, productos de degradación, aditivos). Para ello se recomienda:
• Pesar por triplicado muestras placebo (colorantes, excipientes, cápsulas vacías etc.), a concentración equivalente a la que contendría la dosis mayor y menor.
• Transferir la mezcla a vasos conteniendo medio de disolución a 37°C y agitar durante 1 hora a 150 rpm.
• Analizar las muestras.
• Calcular el porcentaje de interferencia a cada una de las concentraciones (n = 3), comparando con una solución estándar al 100% de la dosis.
La fórmula para calcular la interferencia en el método analítico es:

Donde:
I = Interferencia (en %)
C = Concentración de la solución estándar (mg/mL)
Ap y As = Absorbancia o Áreas del placebo y del estándar
V = Volumen de medio en el vaso (mL)
L = Dosis del producto, según rótulo (mg)
Especificación: La interferencia media no debe exceder el 2%
Si no se conoce la composición del placebo, se recomienda realizar la disolución de la formulación y analizarla. Luego, comparar la respuesta del compuesto a analizar contra una solución patrón o de referencia. Si el método es cromatográfico, se recomienda evaluar la interferencia de los picos en el tiempo de retención del analito.
5.2.2 Linealidad y Rango
Rango es el intervalo entre la concentración superior e inferior de concentración del analito en la muestra que ha demostrado que el método presenta un nivel adecuado de precisión, exactitud y linealidad. El rango de concentraciones se calcula de los estudios de linealidad.
• Si el método es espectrofotometría UV: determinar la longitud de onda máxima de absorción.
• Preparar una solución al 100% y determinar su respuesta (Absorbancia).
• Verificar si hay necesidad de diluir.
• Verificar que el medio no absorba a la misma longitud de onda.
• Si el método es por HPLC, se debe verificar que el medio no interfiera en el tiempo de retención del analito.
• Preparar una curva equivalente entre 10-120% de IFA disuelto.
Linealidad es la capacidad de un método analítico de asegurar que los resultados obtenidos son directamente proporcionales a la concentración del analito en la muestra. Para ello:
• Se prepara la curva de calibración.
• Se calculan el coeficiente de correlación, el intercepto, la pendiente y la suma de cuadrados residuales.
• El coeficiente de correlación no deberá ser menor a 0,98, el intercepto en “y” no debe ser diferente de 0, empleando un intervalo de confianza de 95%.
• El coeficiente de variación del factor de respuesta no debe ser mayor del 2%.
5.2.3 Exactitud
Expresa la cercanía entre el valor verdadero y el valor que es aceptado (sea como un valor convencional verdadero o un valor de referencia aceptado). La definición práctica indica que corresponde a la relación estrecha que existe entre la media aritmética obtenida de varios resultados analíticos en el procedimiento en estudio y el valor real o de referencia, lo cual está influenciado por errores sistemáticos como, por ejemplo, equipos de medición inadecuados, calidad incorrecta de los reactivos y método analítico inapropiado. Para ello se recomienda:
• Pesar el IFA (por triplicado) para obtener 3 concentraciones conocidas (incluyendo concentraciones mínima y máxima del intervalo).
• Añadir el IFA a vasos de disolución conteniendo el placebo.
• Analizar las muestras.
• Criterio: Una recuperación del 95-105% es aceptable. La desviación estándar relativa deberá ser =2%.
5.2.4 Precisión del método
Expresa la coincidencia (grado de dispersión) entre una serie de múltiples muestreos de una misma muestra homogénea, bajo condiciones establecidas. Corresponde al grado de concordancia de los datos obtenidos para una muestra procesada varias veces, lo que está limitado por errores aleatorios como los errores instrumentales e individuales, entre otros. Para ello se recomienda:
• Analizar réplicas de una solución estándar (n = 6).
• Calcular la desviación estándar relativa.
• Criterio: La desviación estándar relativa no deberá ser mayor al 2%.
5.2.5 Precisión Intermedia
Expresa la variación en los resultados observados cuando uno o más factores, tales como tiempo, equipamiento, operador, varían dentro de un mismo laboratorio. Dos analistas diferentes realizan dos estudios cinéticos de disolución (n=12) y se comparan los resultados promedio y los coeficientes de variación (%). La diferencia en los valores promedio, no debe exceder un 10% en aquellos tiempos en los que se ha disuelto = 85% y un 5% en los que se ha disuelto más del 85% del IFA en estudio.
5.2.6 Robustez
Se debe determinar durante la fase de desarrollo del método. Corresponde a una medida de la capacidad de un procedimiento analítico de entregar resultados analíticos con exactitud y precisión aceptables, frente a cambios pequeños, pero deliberados, en los parámetros del método (por ej., en un método espectrofotométrico, frente a pequeños cambios en la longitud de onda). Para ello, se recomienda realizar cambios pequeños, pero deliberados a las condiciones de disolución (n = 3). Dependiendo del método, los cambios pueden ser los siguientes:
• Soluciones reguladoras, modificar pH en 0,5 unidades arriba o abajo.
• HPLC: cambios de columna, flujo de la fase móvil, pH de la fase móvil, etc.
• Espectrofotometría UV: cambios en la longitud de onda ± 2 nm.
5.2.7 Estabilidad
Se debe asegurar la estabilidad de la solución estándar y de las muestras hasta el momento de su análisis. Para determinar la estabilidad de la solución estándar se recomienda almacenarla en condiciones que aseguren su estabilidad (por ej. en refrigeración), analizarla en el período de tiempo especificado y comparar el resultado con el obtenido con una solución estándar recientemente preparada. El rango de recuperación deberá estar entre 98-102% del valor promedio. Para el caso de las muestras se debe proceder de la misma forma. Vale decir, almacenar la solución en condiciones que aseguren su estabilidad, analizarla en el tiempo establecido y comparar el resultado con el obtenido inmediatamente de extraída la muestra desde el vaso de disolución. El porcentaje de recuperación deberá encontrarse entre 98-102% del valor promedio.
5.2.8 Interferencia del Filtro
Se analiza una solución de concentración conocida, luego se filtra y se mide nuevamente. Se comparan ambos resultados, siendo aceptable un rango de recuperación entre 98-102%.
5.2.9 Validación del muestreo automatizado
Se construyen dos perfiles de disolución con 6 unidades posológicas, muestreando simultáneamente de manera manual y automática, y se comparan los resultados obtenidos usando el criterio indicado en 5.2.5 Precisión Intermedia.
6. DOCUMENTACIÓN NECESARIA PARA RESPALDAR UNA SOLICITUD DE BIOEXENCIÓN
6.1 Solicitud de aprobación de Protocolo de Bioexención y Diseño de los estudios in vitro. Presentación de resultados
Previo a la realización de los estudios in vitro (solubilidad, permeabilidad y cinética de disolución), los interesados deberán presentar al INAME la solicitud de bioexención correspondiente.
Se deberán completar los siguientes anexos según el caso (ver al final de la presente guía):
-Anexo I: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en la Clasificación Biofarmacéutica”.
-Anexo II: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en formulaciones proporcionalmente similares”.
-Anexo III: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 556/09. Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado Bioequivalencia”.
En todos los casos, la ANMAT procederá a autorizar la realización de dichos estudios, si considera adecuada la información aportada. En caso de que la solicitud no corresponda, el trámite será denegado.
Las áreas involucradas en la evaluación de la solicitud de bioexención serán las responsables de otorgar la conformidad o de señalar los cambios que se estimen pertinentes en los protocolos de estudio. La ANMAT, autorizará al laboratorio Solicitante a llevar a cabo la demostración de equivalencia por metodología in vitro. En consecuencia, éstos sólo podrán realizarse una vez extendida la aprobación oficial de los protocolos por parte de la ANMAT.
Para presentar los resultados obtenidos se deberán completar los anexos correspondientes según el caso (ver al final de la presente guía):
-Anexo IV: “PRESENTACIÓN DE RESULTADOS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en la Clasificación Biofarmacéutica”.
-Anexo V: “PRESENTACIÓN DE RESULTADOS DE PROPORCIONALIDAD DE DOSIS PARA SOLICITAR UNA BIOEXENCIÓN SEGUN DISPOSICIÓN ANMAT N° 758/09”.
-Anexo VI: “DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE CAMBIOS POSTERIORES A LA APROBACIÓN DE UN REGISTRO PARA SOLICITAR UNA BIOEXENCIÓN SEGUN DISPOSICIÓN ANMAT N° 556/09”.
Las áreas involucradas en la evaluación de los resultados serán las responsables de otorgar la conformidad o de requerir al laboratorio documentación, pruebas adicionales, o demostración de equivalencia in vivo, según corresponda.
En caso de resultar aceptable la información aportada en el trámite, la ANMAT aceptará la bioexención, mediante una Disposición aprobatoria.
6.2 Información sobre el laboratorio y el producto farmacéutico multifuente para el cual se solicita la bioexención
6.2.1 Datos del laboratorio solicitante
El interesado deberá completar los requisitos correspondientes del formulario de la solicitud de bioexención.
6.2.2 Requisitos sobre el producto multifuente en estudio
El interesado deberá completar los requisitos correspondientes del formulario de la solicitud de bioexención.
En los casos de formulaciones no registradas, la autorización para la realización de los estudios de bioexención no se efectivizará hasta que, las áreas técnicas correspondientes del ANMAT, hayan evaluado y aceptado la solicitud de registro. En los casos de formulaciones previamente registradas, deberá incluirse en la solicitud de bioexención el número de certificado correspondiente.
6.2.3 Establecimiento/s propuesto/s para realizar los estudios del Producto/s, y en caso de corresponder, de los IFA
Para cada uno de los ensayos de solubilidad, permeabilidad y cinética de disolución, ya sean realizados por el solicitante o tercerizados, se deberán completar los ítems mencionados en el formulario correspondiente.
6.2.4 Caracterización de elaboración y Buenas Prácticas de Fabricación y Control.
6.2.4.1 Caracterización de elaboración
Para el IFA en estudio se deberá presentar documentación que avale:
a) El cumplimiento de las especificaciones de calidad y consistencia en resultados obtenidos con los lotes propuestos para los estudios de bioequivalencia o equivalencia in vitro del producto multifuente.
b) Se deberá declarar la función que cumple cada excipiente en la formulación, dado que existe evidencia científica de que algunos excipientes pueden modificar la motilidad y/o permeabilidad del tracto gastrointestinal. De la misma forma, se deberá presentar un cuadro comparativo con la composición cuali/cuantitativa de los productos de referencia y multifuente, a los fines de establecer la adecuabilidad de los excipientes según ítem V Excipientes de la Disposición ANMAT N° 758/09.
6.2.4.2 Caracterización de Buenas Prácticas de Fabricación y Control
Para el IFA en estudio se deberá presentar documentación que avale que el proceso de elaboración ha sido validado y que la fabricación del producto se ha realizado siguiendo las Buenas Prácticas Fabricación y Control vigentes (Disposición ANMAT N° 2819/2004 o la/s que en el futuro la complemente o modifique).
6.3 Datos que respaldan la alta solubilidad del IFA
Se deberán presentar resultados respaldando la alta solubilidad del IFA detallando:
• Descripción del método analítico, la validación del mismo y composición de soluciones reguladoras.
• Información acerca del IFA, detallando estructura química, el peso molecular, naturaleza química (ácido, base, anfótero o neutro), constante de disociación y valores de los coeficientes de partición y distribución del mismo.
• Representación gráfica de los resultados de solubilidad en un gráfico solubilidad vs pH.
• Resultados individuales de solubilidad, indicando el pH de la solución empleada, expresados en unidades de concentración (mg/mL) y el volumen del medio requerido para disolver la mayor concentración posológica. Resultados promedios. Desviación estándar.
6.4 Datos que respaldan la alta permeabilidad del IFA en caso de que no esté en el listado de la OMS
Se deberán presentar resultados propios y antecedentes científicos válidos que avalen la permeabilidad del IFA utilizado en la elaboración del producto farmacéutico.
En la solicitud, se deberá incluir la siguiente información:
- En caso de utilizar métodos de permeabilidad en humanos, se debe aportar información acerca del diseño del estudio y de los métodos farmacocinéticos, analíticos y bioestadísticos utilizados, junto con los datos farmacocinéticos “crudos” del estudio. De acuerdo con los requisitos enumerados en: Disposiciones ANMAT N° 6677/10, 3185/99, 3598/02, 5040/06 y la/s que en el futuro la/s modifiquen o complementen.
- En caso de utilizar métodos de permeabilidad alternativos, se debe presentar descripción del método de estudio de permeabilidad a emplear, criterios de selección de animales o línea celular, concentraciones del IFA a emplear en fluido donante e informe de validación del método analítico.
Se debe entregar en detalle el listado de IFAS modelo utilizados para la Validación del método de estudio de la permeabilidad, los valores de permeabilidad (promedio, desviación estándar y CV%), y un gráfico de fracción absorbida en humanos en función de la permeabilidad, identificando el límite de permeabilidad alta/baja y el patrón interno seleccionado para este fin. El número de IFAS modelo deberá ser quince (15). Esta lista deberá incluir IFAS de permeabilidad alta, moderada y baja, además de un IFA punto de corte (p. ej., metoprolol) incluyendo en todos los casos su respectiva clasificación biofarmacéutica.
6.5 Datos que respaldan la cinética de disolución
En el trámite de solicitud de bioexención de un producto, deberán presentar información sobre las características del equipo de disolución utilizado (marca, equipo, calibración, etc).
Por otro lado, basado en el SCB del IFA, se deberá presentar información que respalde las características de rápida o muy rápida disolución (punto 3.1.2 de este documento).
6.6 Evaluación de la solicitud de bioexención
En caso de resultar aceptable la información aportada en el trámite y la/las metodología/s propuesta/s para los ensayos correspondientes, la ANMAT aceptará la solicitud de bioexención, que autorizará al laboratorio solicitante a llevar a cabo la demostración de equivalencia por metodología in vitro.
Si la solicitud de bioexención es objetada, la ANMAT requerirá al laboratorio documentación, pruebas adicionales o demostración de equivalencia in vivo, según corresponda.
6.7 Verificación técnica
En caso de tratarse de un producto aún no comercializado, corresponderá realizar la verificación técnica de acuerdo a la Disposición ANMAT N° 5743/09.
El laboratorio deberá comunicar fehacientemente con 30 días de anticipación el inicio de los estudios de cinética comparativa de disolución. El personal técnico de la ANMAT podrá presenciar o de ser necesario, repetir o hacer repetir parcial o totalmente el estudio comparativo. En caso de realizar los ensayos de solubilidad y permeabilidad, se deberá comunicar con el mismo lapso de tiempo, el período en el cual se realizarán dichos ensayos.
6.8 Retención de Contramuestras
Se deberán mantener tres contramuestras de los lotes de los productos de referencia y multifuente utilizados en los ensayos, durante 2 años y 6 meses desde el momento de la aprobación del estudio, respetando las condiciones de almacenamiento indicadas en el rotulado. Cada contramuestra deberá contener al menos 60 unidades de cada producto.
6.9 Presentación de resultados
Los resultados de los estudios de solubilidad, permeabilidad y del estudio de cinética de disolución comparativa deberán presentarse de acuerdo a los formularios correspondientes, independientemente de si el personal técnico de la ANMAT hubiera o no presenciado los estudios.
Los resultados obtenidos en los estudios comparativos deberán informarse de acuerdo a la solicitud aprobada, completando en cada caso la tabla que corresponda en el Anexo VII: “GUÍA DE BIOEXENCIONES. RESULTADOS DE LOS ESTUDIOS DE DISOLUCIÓN”. Se indicará el porcentaje de IFA disuelto en cada intervalo de prueba, para cada unidad posológica individual, consignándose el porcentaje promedio de IFA disuelto, el rango (mayor y menor) de disolución y el coeficiente de variación (desviación estándar relativa).
En la comparación de los productos multifuente (M) y referencia (R), se deberá confrontar los perfiles cinéticos de disolución usando el factor de similitud (f2); cuando esta metodología no fuese adecuada pueden aplicarse metodologías estadísticas alternativas siempre que las mismas sean válidas y justificadas satisfactoriamente. El factor de similitud corresponde a la transformación logarítmica de la raíz cuadrada recíproca de la suma del error cuadrado y proporciona una estimación de la similitud en las cinéticas de disolución entre ambos productos.

Los dos perfiles se consideran similares cuando el valor de f2 es = 50.
Para permitir el uso de datos promedio, el coeficiente de variación no deberá ser más del 20% en los puntos temporales más tempranos del perfil de disolución (p.ej., 5 o 10 minutos), y no más del 10% en los demás puntos temporales del perfil.
Para el cálculo de f2 se requiere un mínimo de tres puntos temporales (excluir el cero y tomar un solo punto temporal en el que el valor de disolución para el producto de referencia sea igual o mayor al 85%). Un valor de f2 de 50 o mayor (50-100) refleja la equivalencia de las dos curvas.
Cuando el IFA contenido tanto en el producto de referencia como en el producto multifuente en estudio, se disuelve en un porcentaje de 85% o más de la cantidad declarada del IFA a los 15 minutos o menos, utilizando los medios de disolución que correspondan, la disolución de los productos es considerada equivalente y no es necesaria la comparación de perfiles.
6.10 Aceptación o rechazo de la Equivalencia
6.10.1 Bioexención basada en el SCB del IFA
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto presentado respecto al producto de referencia.
6.10.2 Bioexención por formulaciones proporcionalmente similares
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto presentado respecto al de referencia (diferente dosis del mismo producto con equivalencia aceptada).
6.10.3 Bioexención por cambios post aprobatorios según Disposición ANMAT N° 556/09
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto con los cambios propuestos respecto al producto con equivalencia demostrada.
7. CÓMO TRAMITAR UNA BIOEXENCIÓN
7.1 Protocolo del estudio
Se deberá completar el Formulario de Solicitud de Bioexención correspondiente (Anexos I-III). La información solicitada, se presentará en Mesa de Entradas del INAME.
Evaluada la información por las áreas pertinentes, la aceptación del trámite de solicitud se hará mediante nota aprobatoria de la Dirección Nacional.
7.2 Resultados del estudio
Con el protocolo de solicitud aprobado, una vez terminado el estudio, se deberá completar el Formulario de Presentación de Resultados para una Bioexención (Anexos IV-VII) acompañado con la documentación correspondiente. Esta información deberá ser presentada en Mesa de Entradas INAME para ser incorporada al expediente de Bioexención.
7.3 Certificación de un producto como Equivalente
Frente a la demostración de equivalencia entre el producto multifuente y el producto comparador de referencia, la ANMAT procederá a dictar la disposición correspondiente declarando al producto multifuente PRODUCTO EQUIVALENTE al producto de referencia.
8. DISPOSICIONES ANMAT RELACIONADAS CON LA PRESENTE GUÍA
-5904/96
Definiciones y lineamientos generales acerca del modo en que deberá incluirse la información que deben contener los prospectos de especialidades medicinales cuya condición de expendio sea la de venta bajo receta en sus tres categorías.
-3185/99
Apruébanse las recomendaciones técnicas contenidas en el documento “cronograma para exigencias de estudios de equivalencia entre medicamentos de riesgo sanitario significativo”.
-3311/01
Establécense las condiciones en las cuales deberán realizarse los estudios, de bioequivalencia/biodisponibilidad de las especialidades medicinales que contengan como principio activo individual uno de los antirretrovirales utilizados para el tratamiento de la infección con el virus de la inmunodeficiencia humana, tanto para las actualmente en comercialización, como las registradas y no comercializadas.
-2807/02
Incorporación de a la droga Isotretinoína al cronograma de bioequivalencia. Selección de productos comparadores para estudios de bioequivalencia, para las drogas Carbamazepina, Oxcarbazepina, Valproato, Ciclosporina, Teofilina, Verapamilo, Digoxina e Isotretinoína.
-2819/04
Apruébense los lineamientos generales de Buenas Prácticas de Fabricación para Elaboradores, Importadores/Exportadores de Medicamentos.
-5040/06
Apruébase el Régimen de Buenas Prácticas para la Realización de Estudios de Biodisponibilidad/Bioequivalencia.
-1746/07
Sustitúyese el Anexo I de la Disposición N° 5040/2006, referido al Régimen de Buenas Prácticas para la Realización de Estudios de Biodisponibilidad/Bioequivalencia.
-2446/07
Incorpóranse determinados principios activos (Serolimus, Everolimus, Tacrolimus y Micofenolato) a la exigencia de realización de estudios de Bioequivalencia/Biodisponibilidad, establecidos por la Disposición N° 3185/99.
-556/09
Apruébase la Guía para aplicar en los Cambios de Escala y Cambios Posteriores al Registro de Medicamentos Sujetos a Demostración de Bioequivalencia.
-758/09
Criterios de Bioexención de Estudios de Bioequivalencia para Medicamentos sólidos orales de liberación inmediata.
-5743/09
La evaluación de la información relacionada con los métodos de control, elaboración, ensayos farmacotécnicos, estudios de estabilidad, capacidad operativa para elaborar y/o de control incluida en las solicitudes de inscripción en el registro de especialidades medicinales, se realizara mediante la verificación técnica de dicha información, debiendo cumplimentarse los requisitos establecidos en la Disposición ANMAT N° 2819/2004 o la que en el futuro la reemplace y las especificaciones de calidad establecidas en la farmacopea argentina, farmacopea brasileña y/u otra farmacopea internacionalmente reconocida.
-6677/10
Apruébase el Régimen de Buena Práctica Clínica para Estudios de Farmacología Clínica.
-3113/10
Incorpóranse a la exigencia de realización de estudios de Bioequivalencia / Biodisponibilidad, establecidos por la Disposición (ANMAT) N° 3185/99, a los ingredientes farmacéuticos activos Lamotrigina y Topiramato
-1263/12
Establécese que, a los fines de la realización del estudio de bioequivalencia o equivalencia “in vitro”, según corresponda, el laboratorio patrocinante deberá proponer alguna de las tres opciones siguientes: a) tres lotes vigentes, de escala industrial, idénticos al producto a comercializarse, b) tres lotes pilotos de tamaño no menor a las 100.000 unidades o c) tres lotes pilotos sin establecer un tamaño mínimo de unidades; las opciones b) o c) solo serán aceptables siempre que los lotes se elaboren en equipos de escala industrial que se encuentren calificados para ese tamaño de lote y que sean idénticos en capacidad y principio de funcionamiento a los que se emplearan para producir los lotes a comercializar.
-4132/12
Exigencia de demostración de bioequivalencia establecida en la Disposición ANMAT N° 3185/99, a todas las concentraciones comercializadas y/o a comercializarse de una especialidad medicinal, de forma farmacéutica sólida oral, que contenga alguno de los Ingredientes Farmacéuticos Activos incluidos en la normativa nacional sobre estudios de bioequivalencia y en disposiciones complementarias posteriores de exigencia de bioequivalencia.
-4326/12
Adóptanse como criterios de riesgo sanitario, para la inclusión de ingredientes farmacéuticos activos en el cronograma de exigencia de estudios de bioequivalencia in-vivo, a los obrantes en el Anexo I de la presente disposición.
-4788/12
Incorpóranse a las exigencias de realización de estudios de Bioequivalencia/Biodisponibilidad, establecidas por Disposición (ANMAT) N° 3185/99, a los ingredientes farmacéuticos activos que figuran en el Anexo I de la presente disposición, que forma parte integrante de la misma.
-1918/13
Establécense los criterios para la selección de una especialidad medicinal como producto de referencia para los estudios de Bioequivalencia y Equivalencia In-Vitro que figuran en el Anexo I de la presente disposición, que forma parte integrante de la misma.
-2434/13
Establécese que los titulares de laboratorios de especialidades medicinales que contengan IFAS, respecto de los cuales esta Administración Nacional exige la realización de estudios de Bioequivalencia, que soliciten la aprobación de resultados de estudios realizados en el exterior, deberán cumplir con los requisitos que se detallan en el Anexo I de la presente Disposición.
9. REFERENCIAS
1- Amidon G. L., Lennernäs H., Shah V. P. and Crison J. R. A. Theoretical Basis for a Biopharmaceutics Drug Classification: The Correlation of In vitro Drug Product Dissolution and In vivo Bioavailability. Pharmaceutical Research,12(3):413-420, 1995.
2- FDA, 1997. Guidance for Industry: Dissolution Testing of Immediate Release Solid Oral Dosage Forms, US Center for Drug Evaluation and Research, USA.
3- Fan de Waterbeend H. Fundamental Variables of the Biopharmaceutics Classification System (BCS: A Commentary). European Journal of Pharmaceutical Sciences, Vol 7: 1-3, 1998.
4- Chenga C-L., Yub L. X., Leec H-L., Yangd C-Y., Luee C-S., Chen C-H. Biowaiver extension potential to BCS Class III high solubility-low permeability drugs: bridging evidence for metformin immediate-release tablet. European Journal Pharmaceutical Scinces,22, 297-304, 2004.
5- Lindenberg M., Koop S. and Dressman J.B. Classification of. orally administered drugs on the World Health Organization Model list of Essential Medicines according to the biopharmaceutics classification system. Eur. J. Pharm. Biopharm., 58, 265 - 278, 2004.
6- Polli J. E., Yu L. X., Cook J. A., Amidon G. L., Borchardt R. T., Burnside B. A., Burton P. S., Chen M. L. Conner D. P., Faustino P. J., Hawi A. A., Hussain A. S. Joshi H. N., Kwei Lee V. H. Lesko L. J., Lipper R. A., Loper A. E., Nerurkar S., Polli J. W., Sanvordeker D. R., Taneja R. Uppoor R. S., Vattikonda C. S., Wilding I., Zhang G. Summary Workshop Report: Biopharmaceutic Classification System-Implementation Challenges and Extension Opportunities. J. Pharm. Sci., 93 (6), 1375 - 1381, 2004.
7- FDA, 2000. Guidance for industry: Waiver of In vivo Bioavailability and Bioequivalence Studies for Immediate Release Solid Oral Dosage Forms based on Biopharmaceutics Classification System. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
8- Yu L.X., Amidon G., Polli J., Zhao H., Mehta M., Conner D., Shah V., Lesko L., Chen M, Lee V. and Hussain A. Biopharmaceutics Classification System: The Scientific Basis for Biowaiver Extensions, Pharml Res., 19(7):921-5, 2002.
9- Bermejo M. and Amidon G. “Bioequivalencia In Vitro. ¿Porqué, cuando y cómo Aplicación del BCS (Sistema de Clasificación Biofarmacéutico). En: Primer Encuentro Iberolatinoamericano de Academias de Farmacia. Valparaíso Chile, Abril 2005.
10- Yazdanian N., Briggs K., Jankosky C. and Hawi A. The “High Solubility” definition on the current FDA Guidance on Biopharmaceutical Classification System may be too strict for acidic drugs. Pharml Res, 21(2): 293-299, 2004.
11- Le Cluyse E. and Sutton, S. In vitro models for selection of development candidates. Permeability Studies to defined mechanisms of absorption enhancement. Adv. Drug Del. Rey., 23:163-183, 1997.
12- Farmacopea Nacional Argentina. Séptima edición.
13- USP 38. United States Pharmacopeia
14- FDA, 1987. Guideline on General Principles of Process Validation. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
15- ANVISA. Dispõe sobre o Guia para isençáo e substituição de estudos de biodisponibilidade relativa/bioequivalência e dá outras providências. RESOLUÇÃO. RDC N° 37, 3 DE AGOSTO DE 2011.
16- Instituto de Salud Pública de Chile, 2007. Guía Técnica G-BIOF 02: Bioexención de los estudios de Biodisponibilidad/Bioequivalencia para establecer Equivalencia Terapéutica de Formas Farmacéuticas Sólidas Orales. Sección de Biofarmacia.
17- FDA, 2000. Formas posológicas orales sólidas de liberación inmediata Cambios de escala y posteriores a la aprobación: documentación química, de fabricación y controles, de pruebas de disolución in vitro y bioequivalencia in vivo. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
18- Health Canada. Release of Guidance Document: Biopharmaceutics Classification System Based Biowaiver. May 30, 2014; File number: 14-105447-315.
19- European Medicines Agency (EMA), Guideline on the Investigation of Bioequivalence. London, 20 January 2010.
20- WHO technical report series. WHO Expert Committee on Specifications for PharmaceuticaI Preparations. Forty-nineth report. Geneva, World Health Organization, 2015 (WHO Technical Report Series, No. 992): 131.
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo I: Bioexención basada en la Clasificación Biofarmacéutica.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación
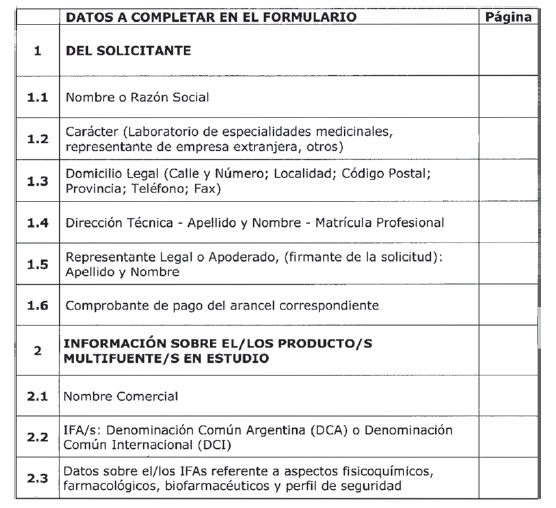


Tabla 1: Datos de disolución in vitro para la Bioexención requerida.
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo II: Bioexenciones basadas en formulaciones proporcionalmente similares.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación

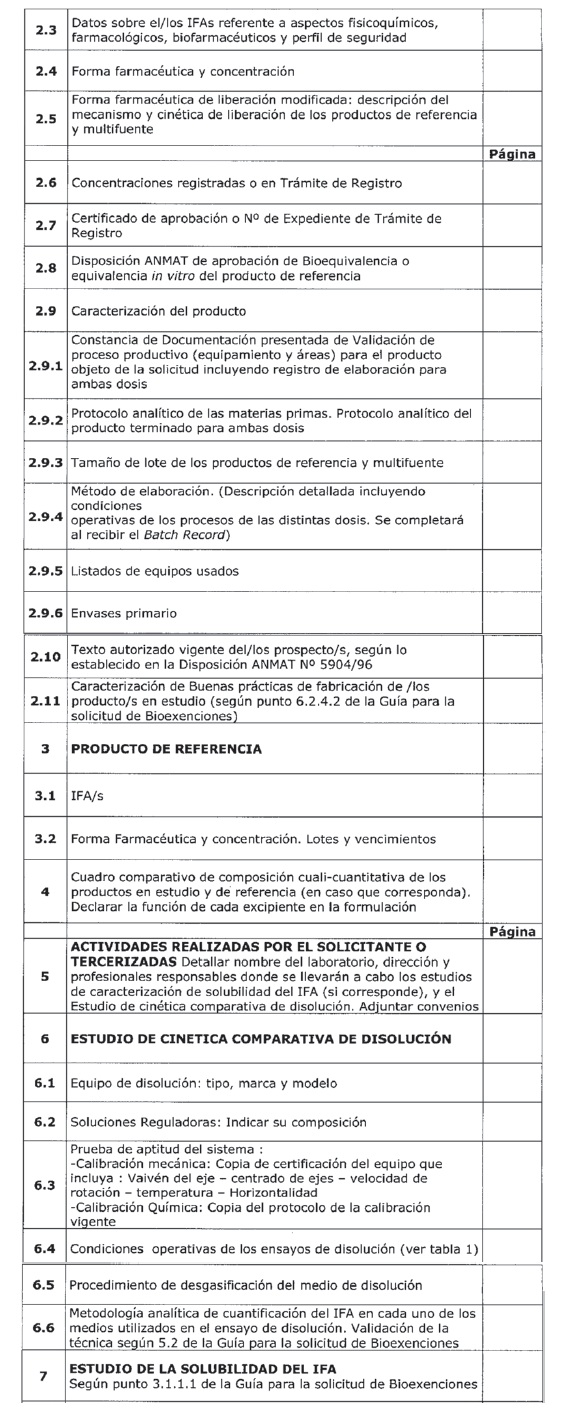

Tabla 1: Datos de disolución in vitro para la Bioexención requerida
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 556/09
Anexo III: Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado bioequivalencia o equivalencia in vitro basado en la clasificación biofarmacéutica.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación

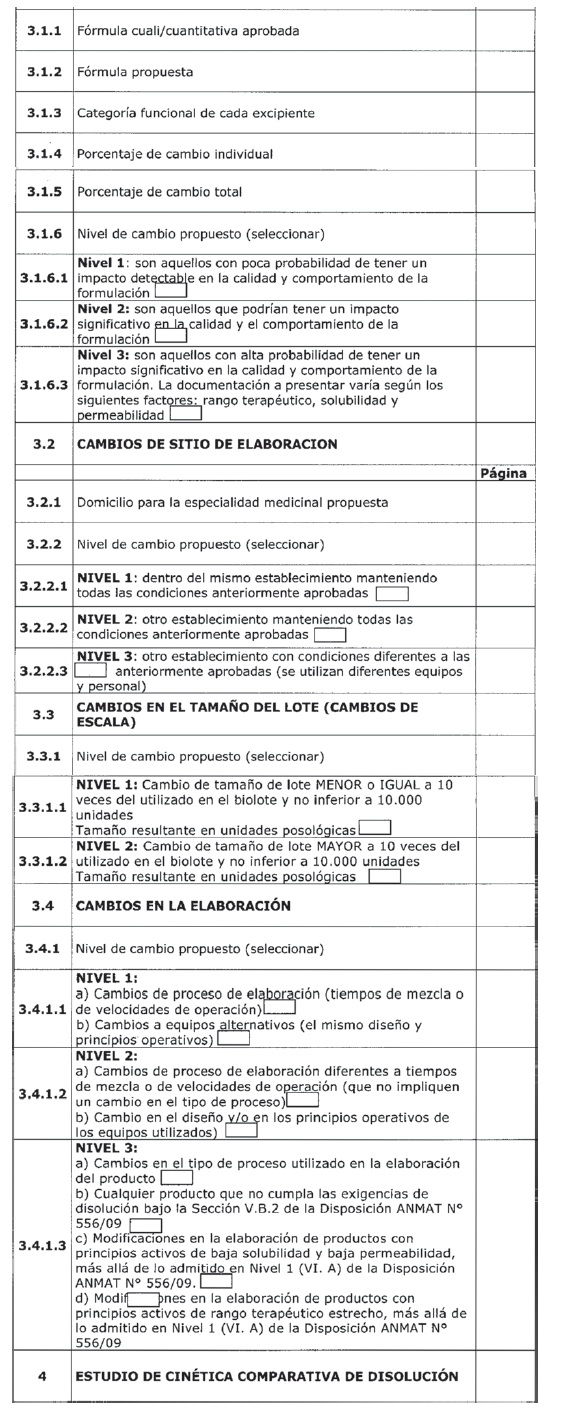
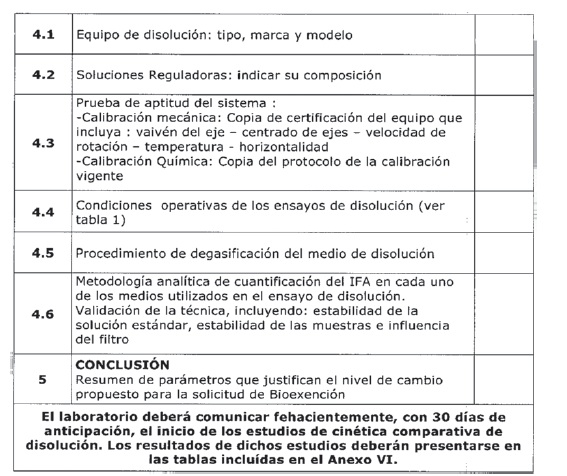
Tabla 1: Datos de disolución in vitro para la Bioexención requerida.
DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09.
Anexo IV: Bioexención basada en la Clasificación Biofarmacéutica
INFORMACIÓN - DOCUMENTO


DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE PROPORCIONALIDAD DE DOSIS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo V: Bioexenciones basadas en formulaciones proporcionalmente similares
INFORMACIÓN - DOCUMENTO


DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE CAMBIOS POSTERIORES A LA APROBACIÓN DE UN REGISTRO PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 556/09
Anexo VI: Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado Bioequivalencia o equivalencia in vitro
INFORMACIÓN - DOCUMENTO

DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE ESTUDIOS DE CINETICA DE DISOLUCIÓN
Anexo VII: Planillas para la presentación de los resultados individuales de los estudios de cinética de disolución.
Planillas modelo para completar con los resultados de los estudios cinéticos para ambos productos en cada uno de los medios requeridos. Se deberá presentar una planilla para cada producto en cada medio utilizado por separado.
Las planillas contienen datos mínimos a ser presentados de los estudios cinéticos y deberán estar acompañadas de los datos crudos. Asimismo cualquier información adicional podrá ser adjuntada en este anexo.
SECRETARÍA DE POLÍTICAS, REGULACIÓN E INSTITUTOS
ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
Disposición 6766/2016
Bs. As., 29/06/2016
VISTO la Ley N° 16.463, sus Decretos Reglamentarios N° 9763/64 y .° 150/92 (T.O. Decreto 177/93), la Resolución ex Secretaría de Políticas, Regulación y Relaciones Sanitarias N.° 46/03, las Disposiciones ANMAT N° 5904/96, N° 3185/99 con sus complementarias y modificatorias, N° 3311/01, N° 2807/02, N° 2819/04, N° 5040/06, N° 1746/07, N° 2446/07, N° 556/09, N° 758/09, N° 5743/09, N° 6677/10, N° 3113/10, N° 1263/12, N° 4132/12, N° 4326/12, N° 4788/12, N° 1918/13 y N° 2434/13, el Informe de la Organización Mundial de la Salud N° 992/2015 (Anexo 7), y el Expediente N° 1-47-1110-311-14-0 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica; y
CONSIDERANDO:
Que los estudios de bioequivalencia en humanos han sido aceptados en los últimos 25 años como un requisito sobre el cual se basan las agencias regulatorias de medicamentos para establecer la equivalencia terapéutica de los productos farmacéuticos multifuentes con respecto a un producto de referencia.
Que por Disposición ANMAT N° 3185/99 se aprobaron las recomendaciones técnicas para la realización de estudios de equivalencia contenidas en el documento denominado: “Cronograma para exigencia de estudios de equivalencia entre medicamentos de riesgo sanitario significativo”, y mediante disposiciones posteriores, esta Administración Nacional ha ido incorporando ingredientes farmacéuticos activos a la obligatoriedad de demostración de bioequivalencia.
Que la Organización Mundial de la Salud (OMS) en su Serie de Informes Técnicos N° 937 —Anexo 8— ha considerado al Sistema de Clasificación Biofarmacéutica (SCB) como una herramienta válida de clasificación de aquellos principios activos que solo requieren demostraciones de equivalencia in vitro exceptuándolos de estudios in vivo.
Que el SCB se basa en la solubilidad acuosa y la permeabilidad intestinal del principio activo; cuando estas dos propiedades se combinan con la disolución del medicamento se obtienen los tres factores que determinan la velocidad y la cantidad de principio activo absorbido desde una forma farmacéutica oral de liberación inmediata, permitiendo establecer la inferencia de la Bioequivalencia.
Que de acuerdo a los principios del SCB surgen dos conceptos aplicables a los productos farmacéuticos multifuentes: el de estudios de equivalencia in vitro y el de bioexenciones.
Que la introducción del SCB ha provocado un gran impacto en la práctica regulatoria al establecer las pautas para la demostración de la bioequivalencia entre medicamentos mediante ensayos de disolución in-vitro para las formas farmacéuticas sólidas orales de liberación inmediata, limitando así los requerimientos de estudios in vivo.
Que las agencias de medicamentos de los Estados Unidos (Food and Drug Administration, FDA) y de la Comunidad Económica Europea (European Medicines Agency, EMA) han adoptado los criterios del SCB y ambas coinciden en que la bioexención es justificada cuando las drogas tienen alta solubilidad y alta permeabilidad (Clase I), son de amplio margen terapéutico y el producto cumple con determinados criterios de disolución.
Que la OMS en el documento antes mencionado considera exceptuables de la demostración de equivalencia in vivo a las drogas de Clase I y también extiende la bioexención a los productos medicinales que contengan drogas de Clase III (baja permeabilidad / alta solubilidad), criterio recientemente adoptado por la EMA.
Que la demostración de la bioequivalencia mediante ensayos de disolución, permite reducir en forma considerable los tiempos y costos de la realización de estudios in vivo, reemplazar en algunos casos los estudios en humanos y agilizar la ejecución de las políticas sanitarias vigentes con la finalidad de poner al alcance de la población un número cada vez mayor de productos medicinales con equivalencia establecida.
Que es de interés nacional promover la adopción de lineamientos técnicos para mantener el nivel de fiscalización dentro de los parámetros internacionales.
Que en la Disposición ANMAT N° 758/09 se establecieron los requisitos necesarios para reemplazar los estudios de bioequivalencia in vivo por estudios de disolución basados en el Sistema de Clasificación Biofarmacéutico del IFA.
Que es necesario establecer requisitos para la solicitud de Bioexención, en los casos de: solicitudes de exención de los estudios de biodisponibilidad (BD) y/o bioequivalencia (BE) in vivo para formas farmacéuticas sólidas orales de liberación inmediata (FFSO-LI) en base al Sistema de Clasificación Biofarmacéutico (SCB) y para formulaciones sólidas orales proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro, y para cambios posteriores en formulaciones que hayan demostrado BE.
Que a tales fines es necesario adoptar una Guía que aporte las recomendaciones para su implementación.
Que la aplicación de las normas aludidas tiene como finalidad última la protección de la salud de la población mediante la adopción de un modelo fiscalizador de gestión que destina sus esfuerzos a la verificación continua de la eficacia, seguridad y calidad de los productos que aquélla consume.
Que el Instituto Nacional de Medicamentos y la Dirección General de Asuntos Jurídicos han tomado la intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por el Decreto N° 1490 de fecha 20 de agosto de 1992 y el Decreto N° 101 del 16 de diciembre de 2015.
Por ello,
EL ADMINISTRADOR NACIONAL DE LA ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS, ALIMENTOS Y TECNOLOGÍA MÉDICA
DISPONE:
ARTÍCULO 1° — Las solicitudes de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia deberán efectuarse de acuerdo a la “Guía para la solicitud de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia” que como Anexo forma parte integrante de la presente disposición.
ARTÍCULO 2° — La presente disposición entrará en vigencia a partir del día siguiente a su publicación en el Boletín Oficial.
ARTÍCULO 3° — Regístrese. Dése a la Dirección Nacional del Registro Oficial para su publicación. Notifíquese a las Cámaras de Especialidades Medicinales (CILFA, CAEME, COOPERALA, CAPGEN, CAPEMVEL, SAFYBI), Confederación Médica de la República Argentina (COMRA) y la Confederación Farmacéutica Argentina (COFA). Cumplido, archívese. — Dr. CARLOS CHIALE, Administrador Nacional, A.N.M.A.T.
ANEXO
Guía para la solicitud de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia
Guía para la solicitud de Bioexenciones de Ingredientes Farmacéuticos Activos con Requerimiento de Bioequivalencia
1. INTRODUCCIÓN
Esta guía aporta recomendaciones para las solicitudes de exención de los estudios de biodisponibilidad (BD) y/o bioequivalencia (BE) in vivo para formas farmacéuticas sólidas orales de liberación inmediata (FFSO-LI) en base al Sistema de Clasificación Biofarmacéutico (SCB)*; para formulaciones sólidas orales proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro; y para cambios posteriores en formulaciones que hayan demostrado BE.
La presente guía describe:
a) brevemente los fundamentos del SCB.
b) cuándo y cómo se pueden solicitar bioexenciones para FFSO-LI.
c) los métodos recomendados para determinar la solubilidad y la permeabilidad de los ingredientes farmacéuticos activos (IFAS en adelante), y la cinética de liberación-disolución in vitro de los productos farmacéuticos de liberación inmediata.
d) la forma de tramitar una solicitud de bioexención y los antecedentes que deben presentarse a la Administración Nacional de Medicamentos Alimentos y Tecnología Médica (ANMAT).
* El SCB considera Productos de Liberación inmediata a aquellos que presentan Patrones de rápida y muy rápida disolución.
2. EL SISTEMA DE CLASIFICACIÓN BIOFARMACÉUTICO
2.1 Descripción y Fundamento Científico:
El SCB es un marco científico para clasificar los ingredientes farmacéuticos activos (IFAS) en base a su solubilidad acuosa y su permeabilidad intestinal. (1-6)
Cuando se combina con la disolución y el análisis crítico de los excipientes del producto farmacéutico oral de liberación inmediata, el SCB toma en cuenta los factores principales que gobiernan la velocidad y extensión de la absorción del IFA desde el producto farmacéutico: la composición de excipientes, la disolución, solubilidad y la permeabilidad intestinal. (7-8)
Según el SCB, los IFAS se clasifican de acuerdo a la siguiente tabla.
Tabla 1: Clasificación de los IFAS en base al Sistema de Clasificación Biofarmancéutico.
| Clase | Solubilidad | Permeabilidad |
| I | Alta | Alta |
| II | Baja | Alta |
| III | Alta | Baja |
| IV | Baja | Baja |
2.1.1 Solubilidad
Un IFA se considera altamente soluble cuando la dosis más elevada del producto farmacéutico para la vía oral es soluble en un volumen de 250 ml o menos (dosis / solubilidad = 250 ml) en un medio acuoso y en un intervalo de pH comprendido entre 1,2 y 6,8 a 37 ± 1°C. Por ejemplo, si un IFA se encuentra en forma de comprimidos de 500 mg, 850 mg y 1000 mg, ese IFA se considera altamente soluble cuando la dosis más elevada (1000 mg) se disuelve en las condiciones anteriormente citadas. (9-10)
2.1.2 Permeabilidad
Se considera que un IFA es altamente permeable cuando se establece que la fracción absorbida de la dosis administrada en seres humanos es del 85% o más, basándose en una determinación de balance de masa o en la comparación con una dosis de referencia intravenosa. (11)
2.1.3 Cinética de disolución de las FFSO-LI
A los fines de una solicitud de bioexención, se considera que un producto farmacéutico es de muy rápida disolución cuando 85% o más de la cantidad declarada se disuelve dentro de los 15 minutos en un medio de disolución de pH 1,2; 4,5 y 6,8 a 37°C usando el aparato II —paleta— de la Farmacopea Argentina, 7° Ed. Vol 1 (Aparato II.FA.7ma) a 75 rpm o alternativamente el aparato I —canastillo— de la Farmacopea Argentina, 7° Ed. Vol 1 (Aparato I.FA.7ma) a 100 rpm.
Se considera que un producto farmacéutico es de rápida disolución cuando más del 85% de la cantidad declarada se disuelve dentro de los 30 minutos en las mismas condiciones mencionadas anteriormente.
Podrá solicitarse la bioexención para productos farmacéuticos conteniendo IFAS de Clase I si los dos productos a comparar, referencia y multifuente, pueden ser categorizados como de disolución muy rápida o, cuando siendo de disolución rápida sus perfiles de disolución resultan esencialmente similares.
Para productos farmacéuticos conteniendo IFAS de Clase III, en cambio, la bioexención sólo podrá ser solicitada si los dos productos a comparar, referencia y multifuente, pueden ser categorizados como de disolución muy rápida.
2.2 Antecedentes internacionales de las Bioexenciones:
Agencias Regulatorias
La tabla 2 muestra las diferencias, actualmente existentes, entre las clases bioexceptuables para las distintas agencias regulatorias y organizaciones de salud.
Tabla 2: Clases de IFAS bioexceptuables, según diferentes agencias regulatorias y organizaciones de salud.
| Clase I | Clase II | Clase III | Clase IV | |
| EMA | Si | - | Si | - |
| FDA | Si | - | - | - |
| OMS | Si | - | Si | - |
| ANMAT | Si | - | Si | - |
(EMA: Agencia Europea de Medicamentos; FDA: Agencia de Medicamentos de Estados Unidos de América; OMS: Organización Mundial de la Salud)
2.3 Ámbito de aplicación de las Bioexenciones en Argentina:
El método del SCB descrito en esta guía puede emplearse solamente para justificar las bioexenciones de los productos farmacéuticos fabricados conforme a las Buenas Prácticas de Fabricación y Control de Medicamentos.
La aplicación de estas exenciones se ha considerado para:
a) Formas farmacéuticas sólidas orales de liberación inmediata que contienen IFAS pertenecientes a la clase I y/o III.
b) Formulaciones proporcionalmente similares a otro producto cuya equivalencia haya sido demostrada mediante un estudio in vivo o in vitro.
c) Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado BE.
3. APLICACIÓN DE BIOEXENCIONES
3.1 Bioexenciones basadas en el SCB
3.1.1 Metodología para clasificar los IFAS en base a su solubilidad, permeabilidad y determinación de las características cinéticas de disolución de los productos multifuente.
3.1.1.1 Clasificación en base a la solubilidad de los IFAS
Uno de los objetivos del SCB es determinar la solubilidad en equilibrio de un IFA bajo condiciones fisiológicas de pH, para lo cual se deberá determinar la solubilidad en función del pH del IFA en estudio, en un medio acuoso a 37±1°C en tres pH comprendidos entre 1,2-6,8 durante 24 horas. Además, se deberá evaluar un número suficiente de condiciones de pH para definir con precisión el perfil de solubilidad versus pH.
Para la determinación de la solubilidad, resulta conveniente seleccionar las condiciones de pH considerando las características de ionización del IFA en estudio. Por ejemplo, cuando su pKa se encuentra entre 3-5, determinar la solubilidad a pH = pKa; pH = pKa+1; pH = pKa-1, y a pH = 1,2 y 6,8. Se recomienda un mínimo de tres mediciones de solubilidad en cada condición de pH debiendo ser el CV% menor que 5% (CV% = [desvío estándar / media aritmética]*100). Según la variabilidad del estudio, es posible que sea necesario un mayor número de determinaciones para proveer un cálculo de solubilidad confiable. Si el número de muestras es mayor que 3, todas las réplicas deben ser consideradas en el cálculo del desvío estándar.
Para ser utilizadas en los estudios de solubilidad, se consideran apropiadas las soluciones reguladoras estándares descritas en la Farmacopea Argentina Ed. 7° o en el capítulo Reactivos, Indicadores y Soluciones de la Farmacopea de Estados Unidos.(12-13) Si estas soluciones no resultaran apropiadas por razones físicas o químicas, se tendrán que utilizar otras soluciones reguladoras justificando su uso. Se deberá verificar el pH de la solución antes y después de agregar el IFA a la solución reguladora.
Utilizar el método tradicional de agitación en matraz u otros métodos con justificación que avale la capacidad de los mismos de medir la solubilidad en equilibrio del IFA en estudio.
Se deberá determinar la concentración del IFA en las soluciones reguladoras seleccionadas, en las condiciones de pH señaladas, empleando un ensayo validado que indique la estabilidad y que pueda diferenciar el IFA de sus productos de degradación si los hubiere (p. ej., cuantificación por HPLC). (14) Si se observa la degradación del IFA en función de la composición de la solución reguladora y/o del pH, se deberá comunicar el hecho junto con los demás datos de estabilidad recomendados en esta guía. La estabilidad del IFA se evaluará en todas las condiciones experimentales considerando la duración total del estudio (comparación con el valor nominal, en un mínimo de tres repeticiones).
Complementariamente, se deberá establecer la clasificación de solubilidad, calculando el volumen de un medio acuoso suficiente para disolver la mayor concentración posológica de la forma farmacéutica en la gama de pH de 1,2-6,8. De esta forma, se clasificará un IFA como altamente soluble cuando la mayor dosis sea soluble en un volumen = 250 mL de medio acuoso en toda la gama de pH comprendida entre 1,2-6,8. (15-16)
3.1.1.2 Clasificación en base a la permeabilidad de los IFAS
Se puede establecer o referenciar la clasificación de la permeabilidad de un IFA en sujetos humanos empleando los métodos de balance de masa, de BD absoluta o de perfusión intestinal.
Los métodos recomendados que no involucran a sujetos humanos, incluyen la perfusión intestinal in vivo o in situ en un modelo animal apropiado (p. ej., ratas) y/o métodos de permeabilidad in vitro, empleando tejidos intestinales extirpados o monocapas de células epiteliales apropiadas (p. ej., monocapas de células Caco- 2).
Podrá ser suficiente un solo método cuando la BD absoluta es del 85% o más, o cuando se recupera en la orina el 85% o más, del IFA administrado.
Si un sólo método no demuestra en forma concluyente la clasificación de permeabilidad, se deben emplear dos métodos diferentes.
La estructura química y/o ciertos atributos fisicoquímicos de un IFA (p. ej., el coeficiente de partición en sistemas apropiados) pueden proveer información preliminar útil acerca de sus características de permeabilidad (método in sílico). (3) En ciertos casos, los laboratorios pueden considerar el uso de tal información como antecedente adicional de una clasificación determinada por estudios más robustos como los realizados en humanos.
3.1.1.2.1 Estudios farmacocinéticos en el hombre
• Estudios de balance de masa
Para documentar la medida de absorción de un IFA, es posible usar estudios farmacocinéticos de balance de masa que utilizan isótopos estables o un IFA marcado radioactivamente. Sin embargo, debido a que este método puede proveer cálculos altamente variables de la absorción para muchos IFAS, no representa un método de elección, recomendándose emplear otros métodos.
• Estudios de biodisponibilidad absoluta
Se puede utilizar la determinación de la BD oral usando la administración intravenosa como referencia. Según la variabilidad de los estudios, se deberá incluir un número suficiente de sujetos para proveer un cálculo confiable de la tasa de absorción. Cuando se muestra que la BD absoluta de un IFA es del 85% o más, no hacen falta datos adicionales para documentar la estabilidad del IFA en el fluido gastrointestinal.
3.1.1.2.2 Métodos de permeabilidad intestinal
Se pueden utilizar los siguientes métodos para determinar la permeabilidad de un IFA en el sistema gastrointestinal:
(1) estudios de perfusión intestinal in vivo en seres humanos;
(2) estudios de perfusión intestinal in vivo o in situ en modelos animales apropiados;
(3) estudios de permeabilidad in vitro en tejidos intestinales extirpados humanos o animales;
(4) estudios de permeabilidad in vitro en monocapas de células epiteliales.
Para IFAS transportados pasivamente resultan adecuados los modelos animales in vivo o in situ, y los métodos in vitro como los que usan monocapas de células epiteliales animales o células humanas cultivadas.
La baja permeabilidad de algunos IFAS observada en el hombre podría ser resultado de la expulsión de los IFAS por transportadores de membranas como la glicoproteína de eflujo-P (P-gp). Cuando dichos transportadores están ausentes en los modelos, o su grado de expresión es bajo en comparación con el del hombre, puede haber una mayor probabilidad de error en la clasificación de permeabilidad para un IFA sustrato de los transportadores, en comparación con un IFA transportado en forma pasiva. Por lo tanto, deberá caracterizarse la expresión de transportadores conocidos en los modelos seleccionados. Se puede demostrar la expresión funcional de los sistemas de transporte (p. ej., P-gp), empleando IFAS modelos seleccionados o sustancias químicas sustrato de éstos en concentraciones que no saturen el sistema de transporte (p. ej., ciclosporina A, vinblastina, rodamina 123), mediante técnicas como estudios de transporte bidireccional, que muestran una mayor velocidad de transporte en el sentido basolateral-apical en comparación con el sentido apical-basolateral.
Esta guía recomienda limitar el uso de métodos de prueba de permeabilidad no humanos para los IFAS transportados por mecanismos pasivos. Para aplicar el SCB, se puede suponer un transporte pasivo aparente, cuando se satisface una de las siguientes condiciones:
• En el hombre se demuestra una relación lineal (farmacocinética) entre la dosis (p. ej., en una variedad posológica clínica relevante) y mediciones de área bajo la curva (área debajo de la curva de concentración versus tiempo).
• En un modelo animal se demuestra la falta de dependencia de la permeabilidad respecto de la concentración inicial del IFA (p. ej., 0,01; 0,1 y 1 vez la mayor concentración posológica disuelta en 250 mL), medida en el fluido de perfusión in vivo o in situ.
• En un método de cultivo de células in vitro apropiado, cuya expresión de proteínas transportadoras es conocido (p. ej., P-gp), se demuestra la falta de dependencia de la permeabilidad medida in vitro, respecto de la concentración inicial del IFA (p. ej., 0,01; 0,1 y 1 vez la mayor concentración posológica disuelta en 250 mL) en el fluido donante y respecto del sentido de transporte (p. ej., no existe una diferencia estadísticamente significativa entre la velocidad de transporte cuando se mide en el sentido apical-basolateral y cuando se mide en el sentido basolateral-apical, para las concentraciones del IFA estudiadas).
Para demostrar la aptitud de un método de permeabilidad determinado previsto para la aplicación del SCB, se deberá establecer una relación categoría-orden entre los valores de permeabilidad y los datos de absorción del IFA en sujetos humanos, empleando un número suficiente de IFAS-modelo. Se recomiendan 3 IFAS-modelo para los estudios de perfusión intestinal in vivo en el hombre y 15 IFAS modelo, para los estudios de perfusión intestinal in vivo o in situ en animales y para métodos de cultivo de células in vitro. Según la variabilidad del estudio, se deberá usar un número estadísticamente apropiado de sujetos, animales, muestras de tejidos extirpados o monocapas de células, para proporcionar un cálculo confiable de la permeabilidad del IFA. La relación categoría-orden debe permitir la diferenciación entre los IFA con atributos de permeabilidad intestinal Baja, Moderada y Alta. (7) La adecuabilidad del método para la determinación de la permeabilidad, podrá demostrarse mediante la utilización de IFAS modelo seleccionados a partir de su tasa de absorción baja (< 50%), moderada (50 - 85%) y alta (= 85%). En cada caso deberá existir un número equitativo de IFAS entre las tres categorías. Los patrocinadores podrán seleccionar compuestos de la lista de IFAS y/o sustancias químicas para los cuales exista información disponible respecto del mecanismo de absorción, así como también datos confiables de la cantidad de la absorción del IFA en el hombre.
Después de demostrar la aptitud de un método y mantener el mismo protocolo de estudio, no es necesario ensayar nuevamente todos los IFAS modelo seleccionados para los estudios posteriores que tengan como propósito clasificar un IFA. En lugar de ello, se deberá emplear un IFA modelo de baja permeabilidad y un IFA modelo de alta permeabilidad como patrones internos (incluidos en el fluido de perfusión o en el fluido donante, junto con el IFA que se está estudiando). Estos dos patrones internos se suman al marcador de volumen de fluido o de un compuesto de permeabilidad cero como p. ej., PEG 4000, el cuál se incluye en ciertos tipos de técnicas de perfusión (p. ej., técnicas de lazo cerrado). La selección de patrones internos deberá basarse en la compatibilidad con el IFA en estudio (esto significa que no deberán presentar ninguna interacción física, química o de permeabilidad significativa). Cuando no sea factible cumplir este protocolo, se deberá determinar la permeabilidad de los patrones internos del mismo modo como se realiza la evaluación de permeabilidad del IFA en estudio, en un ensayo paralelo, sobre los mismos sujetos, animales, tejidos o monocapas celulares. Los valores de permeabilidad de los dos patrones internos no deberán diferir significativamente en las distintas pruebas, incluyendo las que se realizan para demostrar la aptitud del método. Al final de una prueba in situ o in vitro, se recomienda determinar la cantidad de IFA en la membrana.
Para un método de prueba determinado, en condiciones experimentales fijas, es posible que el empleo de un patrón interno de alta permeabilidad o cercano al límite del tipo de permeabilidad baja/alta (p. ej., metoprolol), facilite la clasificación del IFA en estudio. Por ejemplo, se podrá determinar que el IFA en estudio es altamente permeable cuando su valor de permeabilidad sea igual o mayor que el metoprolol (IFA punto de corte).
3.1.1.2.3 Inestabilidad en el sistema gastrointestinal
Algunos métodos empleados para determinar la cantidad absorbida de un IFA no tienen en cuenta el alcance de su degradación intestinal, antes de ingresar a la membrana del intestino. Como ejemplo podemos citar: estudios en humanos (balance de masa) que se basan en determinar la radioactividad total del IFA administrado, una vez que llega a la orina; estudios de permeabilidad que se basan en la pérdida o la depuración (clearence) del IFA desde los fluidos introducidos por perfusión en el sistema gastrointestinal humano y/o animal ya sea in vivo o in situ.
Además de los procesos de degradación, la pérdida del IFA desde el sistema gastrointestinal puede producirse por la retención del mismo en la membrana intestinal.
Por lo expuesto, para establecer con certeza la permeabilidad de un IFA, es necesario tener en cuenta los hechos arriba mencionados.
Se deberá documentar la estabilidad del IFA en el sistema gastrointestinal usando fluidos gastrointestinales de modelos animales apropiados y/o fluidos simulados como los Fluidos Gástrico e Intestinal USP a menos que sea posible disponer de fluidos gástricos e intestinales obtenidos de sujetos humanos.
Se deberán incubar los productos farmacéuticos en estos fluidos a 37°C durante un período que sea representativo del contacto del IFA in vivo con estos fluidos; por ejemplo, 1 hora en fluido gástrico y 3 horas en fluido intestinal. Luego se deberán determinar las concentraciones del IFA usando un método analítico validado que indique la estabilidad. Una degradación significativa (> 5%) del IFA en este estudio podría sugerir una posible inestabilidad.
3.1.2 Metodología para determinar las características cinéticas de disolución de los productos multifuente en estudio.
Para la bioexención de un estudio de BE basado en el SCB, tanto el producto multifuente como el producto comparador de referencia, deben exhibir características de disolución in vitro muy rápidas o rápidas, dependiendo de la clase SCB a la que pertenezca el IFA. Adicionalmente, podrá ser requerido que ambos productos presenten similares perfiles de disolución.
3.1.2.1 Demostración de Muy Rápida Cinética de Disolución.
Se debe demostrar que el producto multifuente y el producto comparador de referencia liberan una cantidad = 85% del IFA respecto del valor declarado a los 15 minutos, empleando el Aparato II.FA.7ma a 75 rpm o el Aparato I.FA.7ma a 100 rpm, en un volumen de 900 mL o menos, en cada uno de los siguientes medios:
(1) Solución reguladora de pH 1,2;
(2) Solución reguladora de Acetato a pH 4,5 y
(3) Solución reguladora de Fosfato a pH 6,8.
También son aceptables soluciones reguladoras alternativas con el mismo pH y capacidad buffer, siempre y cuando se demuestre que éstos no afectan algunas de las propiedades fisicoquímicas del medio (p. ej., fuerza iónica) que puedan alterar la cinética de disolución del IFA desde el producto.
3.1.2.2 Demostración de Rápida Cinética de Disolución
Se debe demostrar que el producto multifuente y el producto comparador de referencia liberan una cantidad = 85% del IFA respecto del valor declarado a los 30 minutos, empleando el Aparato II.FA.7ma a 75 rpm o el Aparato I.FA.7ma a 100 rpm, en un volumen de 900 mL o menos, en cada uno de los tres medios mencionados en el punto 3.1.2.1.
3.1.3 Productos a utilizar en el estudio
En un estudio de equivalencia basado en el SCB la diferencia en el contenido del IFA entre producto multifuente y el producto comparador de referencia no debe ser mayor a +/- 5 (Farmacopea Argentina 7ma edición, capítulo <740>)
3.1.3.1 Producto de referencia
El producto de referencia seleccionado deberá ajustarse a los requisitos estipulados en la Disposición ANMAT N° 1918/13 o la/s que en el futuro la complemente o modifique. El lote presentado deberá tener, al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento.
3.1.3.2 Producto multifuente
El laboratorio titular deberá presentar tres lotes independientemente elaborados. Los mismos deben ser iguales a aquellos a comercializarse, en cuanto a fórmula cuali-cuantitativa, calidad de las materias primas, envase primario, método de elaboración, sitio de elaboración, equipos empleados en la elaboración, y método analítico. El tamaño de los lotes y la validación de los procesos productivos deben ajustarse a lo establecido en la Disposición ANMAT N° 1263/12 (o la/s que en el futuro la complemente o modifique), y estar elaborados bajo las Buenas Prácticas de Fabricación y Control vigentes.
3.2 Bioexenciones basadas en formulaciones proporcionalmente similares
3.2.1 Definición de Formulaciones Proporcionalmente Similares
A los fines de solicitar la bioexención, las formulaciones proporcionalmente similares deben ser manufacturadas en el mismo sitio de elaboración y con los mismos procesos que el producto que haya demostrado bioequivalencia/equivalencia in vitro basado en el SCB.
Para las solicitudes de bioexenciones por proporcionalidad, la composición de la/las dosis, deberán ser proporcionalmente similares al producto que haya demostrado BE.
Dos formulaciones proporcionalmente similares pueden ser definidas de dos formas complementarias:
a) Todos los ingredientes de la formulación están exactamente en las mismas proporciones en las diferentes dosis (p. ej., un comprimido de 50 mg de potencia y que posee una cantidad de ingredientes inactivos que es exactamente la mitad de los ingredientes inactivos que posee un comprimido de 100 mg, y el doble de los de un comprimido de 25 mg).
b) En casos donde la cantidad del IFA en el producto es relativamente baja (hasta 10 mg por unidad o no más del 5% del peso total de esa forma farmacéutica). El peso total de la forma farmacéutica se mantiene prácticamente igual para todas las dosis (dentro de ± 10% del peso total), empleando los mismos ingredientes inactivos.
En el caso b) una bioexención por proporcionalidad podrá ser considerada cuando:
- Las cantidades de los diferentes excipientes son los mismos para las distintas dosis consideradas y sólo la cantidad del IFA ha cambiado.
- La cantidad de relleno se ha modificado, como consecuencia del cambio en la cantidad de IFA y las cantidades de los otros excipientes son las mismas para las distintas dosis consideradas.
3.2.2 Bioexención por proporcionalidad según la forma farmacéutica
3.2.2.1 Comprimidos o cápsulas de liberación inmediata
La bioexención de las diferentes dosis de un producto multifuente puede ser considerada cuando:
(I) Las composiciones de las distintas dosis son cuantitativas proporcionales.
(II) Se ha establecido la bioequivalencia/equivalencia in vitro según corresponda para una de las dosis, contra el producto de referencia. Generalmente la dosis estudiada es la mayor, a menos que, por una razón de seguridad se haya establecido la bioequivalencia con una dosis menor o que el IFA sea altamente soluble y posea farmacocinética lineal.
(III) Los perfiles de disolución de la dosis de referencia y la dosis a aprobar, son similares en los tres medios especificados anteriormente y en el medio de control de calidad. En caso de liberarse más de 85% a los 15 minutos, no es necesaria la comparación de perfiles mediante el factor de similaridad (f2).
Si al comparar las distintas dosis se ve afectada la condición sink, se deberá utilizar como producto comparador al producto de referencia utilizado en los estudios de bioequivalencia de igual dosis que el producto multifuente.
Cuando el producto multifuente ha demostrado equivalencia con el producto de referencia basándose en el SCB, la/s nueva/s dosis proporcionales deberán demostrar equivalencia con el producto comparador de referencia de igual dosis.
3.2.2.2 Comprimidos o cápsulas de liberación retardada
Para comprimidos de liberación retardada, cuando el producto está en igual forma farmacéutica, las distintas dosis poseen el mismo mecanismo de liberación, los mismos ingredientes y su composición cuantitativa es proporcionalmente similar, una dosis menor a la dosis con bioequivalencia in vivo aprobada puede ser exceptuada de presentar un estudio de bioequivalencia si tiene un perfil de disolución similar (f2=50) en las condiciones usuales para formas farmacéuticas de liberación retardada (2 horas en medio ácido, seguido de disolución en solución reguladora de pH 6.8).
Al evaluar la proporcionalidad en la composición, se recomienda considerar la proporcionalidad del recubrimiento gastroresistente con respecto a la superficie del comprimido (no del peso del núcleo) para tener el mismo grado de gastrorresistencia (mg/cm2).
En el caso de cápsulas, cuando la diferencia de las dosis es la consecuencia de una disminución en la cantidad de gránulos gastroresistentes que contienen el IFA, la similaridad (f2=50) entre el perfil de disolución de la nueva dosis (menor) y la dosis con bioequivalencia aprobada, en las condiciones usuales de disolución para formas farmacéuticas de liberación retardada, será suficiente para sustentar una bioexención.
3.2.2.3 Cápsulas de liberación prolongada
Para cápsulas de liberación prolongada, cuando la diferencia de dosis es la consecuencia únicamente de una disminución en la cantidad de gránulos que contienen el IFA, la similaridad (f2=50) entre el perfil de disolución de la nueva dosis (menor) y la dosis con bioequivalencia aprobada, realizada en las condiciones de disolución aprobadas para el producto terminado, será suficiente para sustentar una bioexención.
3.2.2.4 Comprimidos de liberación prolongada
Cuando la dosis menor tiene los mismos ingredientes, su composición cuantitativa es proporcionalmente similar, y tiene el mismo mecanismo de liberación, podrá justificarse una bioexención si demuestra similaridad con la dosis con bioequivalencia aprobada, en los perfiles de disolución (f2=50) de por lo menos tres medios de disolución diferentes, de pH entre 1.2 y 7.5 y el medio Cuando la dosis menor tiene los mismos ingredientes, su composición de control de calidad.
3.2.2.5 Farmacocinética lineal
En todos los casos, el solicitante de la Bioexención deberá demostrar o referenciar, además de la proporcionalidad entre las formulaciones, que el IFA posee farmacocinética lineal en el rango de concentraciones terapéuticas. En el contexto de esta guía, se considera farmacocinética lineal cuando un incremento de la dosis resulta en un incremento proporcional del área bajo la curva (AUC). En caso de IFAS con farmacocinética no lineal la sensibilidad del método de disolución puede no ser suficiente para detectar diferencias entre las distintas dosis.
3.2.3 Productos a utilizar en el estudio
Dependiendo del rango terapéutico del IFA, se deberá usar al menos un lote para IFAs de amplio rango terapéutico y al menos dos lotes para IFAS de estrecho margen terapéutico.
3.2.3.1 Producto de referencia
Es el producto cuya titularidad pertenece al mismo laboratorio; generalmente el de dosis más alta que el que se presenta para aprobar, y para el cual la ANMAT ha aceptado la demostración de bioequivalencia con el producto de referencia establecido. En caso que la equivalencia (generalmente el de dosis más alta) haya sido demostrada mediante ensayos in vitro se empleará el producto de referencia, de igual dosis que el producto multifuente, que se ajuste a los requisitos estipulados en la Disposición ANMAT N° 1918/13 o la/s que en el futuro la complemente o modifique.
Deberá tener al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento. Es recomendable la presentación de resultados de valoración y cinética de disolución de más de un único lote del producto de referencia.
3.2.3.2 Producto multifuente
En la solicitud de bioexención, el laboratorio titular deberá presentar lote/s elaborado/s bajo las Buenas Prácticas de Fabricación y Control (Disposición ANMAT N° 2819/2004 o la/s que en un futuro la complemente o modifique).
El tamaño de los lotes y la validación de los procesos productivos deben ajustarse a lo establecido en la Disposición ANMAT N° 1263/12 (o la/s que en un futuro la complemente o modifique).
3.3 Bioexenciones para cambios posteriores a demostración de bioequivalencia
Ciertos cambios menores en la elaboración, de formas farmacéuticas sólidas orales de liberación inmediata, pueden ser autorizados sin riesgo de bioinequivalencia con el biolote, según se establece en la Disposición ANMAT N° 556/09.
3.3.1 Productos a analizar en el estudio
3.3.1.1 Producto de referencia
El lote del producto de referencia presentado deberá tener, al momento del estudio, por lo menos 6 meses hasta la fecha de vencimiento. Es recomendable la presentación de resultados de valoración y cinética de disolución de más de un único lote del producto de referencia. (17)
3.3.1.2 Producto multifuente en estudio
El producto elaborado en las condiciones y/o composición propuestas. El número de lotes dependerá del nivel de cambio aprobado.
4. CONSIDERACIONES ADICIONALES PARA SOLICITAR UNA BIOEXENCIÓN
Cuando se solicita una bioexención basándose en el SCB para los estudios de BD/BE in vivo de FFSO-LI, los solicitantes deberán tener en consideración las siguientes situaciones particulares que pueden afectar su solicitud o la documentación que deberán adjuntar a ésta:
4.1 Excipientes
Algunos excipientes pueden afectar la velocidad y la cantidad de IFA absorbido. Para respaldar una solicitud de bioexención la cantidad de excipientes en el producto farmacéutico de liberación inmediata deberá corresponder a la función prevista (p. ej., lubricantes).
Se deberá establecer la adecuabilidad de los excipientes aportando documentación correspondiente a cualquiera de las siguientes alternativas:
1- El/los excipiente/s están presentes en cantidades similares en el Producto Comparador de Referencia.
2- El /los excipientes están presentes en cantidades similares en productos que contienen el mismo principio activo y poseen autorización de comercialización en países miembros de ICH.
3- El /los excipientes están presentes en el producto en cantidades normalmente empleadas para esa forma farmacéutica. Consultar en el sitio: www.accessdata.fda.gov/scripts/cder/iig/index.cfm de la FDA para búsqueda de ingredientes inactivos utilizados en productos aprobados.
Cuando se incluyen excipientes nuevos o cantidades atípicamente grandes de excipientes de uso común en una forma farmacéutica sólida de liberación inmediata (p. ej., agentes tensoactivos), la ANMAT podrá pedir información adicional que documente la ausencia de un posible impacto sobre la BD del IFA. En determinadas ocasiones, tal información puede proporcionarse con un estudio de BD relativa usando una solución acuosa simple como producto de referencia.
Ciertos excipientes en cantidades inusuales, como surfactantes (p. ej., polisorbato 80) y edulcorantes (p. ej., manitol o sorbitol), podrían ser cuestionables al provocar un posible impacto sobre la BD de IFA. Para las formulaciones que contengan algún/os de estos excipiente/s deben ser cualitativamente los mismos y cuantitativamente similares a aquellos del producto de referencia. (18)
Para formulaciones que solicitan bioexención por proporcionalidad de dosis, la información sobre excipientes, se complementa en el punto 3.2.1 de la presente guía.
Para formulaciones basadas en el SCB que contengan IFAS de clase I, podrá permitise cierta flexibilidad en los excipientes empleados con excepción de los excipientes críticos mencionados anteriormente. (18-20)
Para formulaciones que contengan IFAS de clase III, los excipientes debe/n ser cualitativamente los mismos y cuantitativamente similares a aquellos del producto de referencia. (18-20)
La cantidad relativa de excipientes en dos formas sólidas orales se considera cuantitativamente similar si las diferencia en las cantidades de excipientes se encuentran dentro de los límites descriptos en la tabla 3.
Tabla 3: Diferencia aceptable, expresada como porcentaje (p/p) de la formulación total del producto, para que los excipientes de dos formas farmacéuticas sean considerados cuantitativamente similares.
4.2 Profármacos
La permeabilidad de los profármacos dependerá del mecanismo y del sitio (anatómico) de su conversión en el fármaco propiamente dicho. Cuando se demuestra que la conversión de profármaco en fármaco ocurre predominantemente después del pasaje de la membrana intestinal, se deberá medir la permeabilidad del profármaco. Cuando esta conversión ocurre antes del pasaje de la membrana intestinal, se deberá determinar la permeabilidad del fármaco. Los datos sobre la disolución, así como también de solubilidad en función del pH, para el profármaco pueden ser relevantes. Para optar a una bioexención, los patrocinadores podrían considerar conveniente consultar con el personal de la agencia regulatoria, antes de solicitar el empleo del método del SCB para productos de liberación inmediata que contienen profármacos.
4.3 Situaciones en las que no aplican las bioexenciones
Las bioexenciones en base al SCB no son aplicables para los siguientes productos farmacéuticos:
4.3.1 Productos de estrecho margen terapéutico
Esta guía define a los productos de estrecho margen terapéutico como aquellos que contienen ciertos IFAS que están sujetos a control de la concentración de IFA (monitoreo terapéutico) o a monitoreo farmacodinámico, y/o donde la información científica farmacológica disponible del IFA indica que presenta estrecho margen terapéutico. Los ejemplos incluyen: digoxina, litio, fenitoína, teofilina y warfarina. Ya que no siempre todos los IFAS que están sujetos a monitoreo terapéutico o a monitoreo farmacodinámico son IFAS de productos de estrecho margen terapéutico, en algunas situaciones los patrocinadores deberán contactarse con la agencia regulatoria, para determinar si se debe considerar que un determinado IFA corresponde efectivamente a uno de estrecho margen terapéutico.
4.3.2. Productos diseñados para ser absorbidos en la cavidad oral
Para formas farmacéuticas diseñadas para absorción en la cavidad oral (p. ej., comprimidos sublinguales o bucales), no es apropiada una solicitud de bioexención de estudios de BD/BE in vivo en base al SCB.
5- CONDICIONES EXPERIMENTALES DE LOS ESTUDIOS CINÉTICOS COMPARATIVOS DE DISOLUCIÓN PARA DEMOSTRAR EQUIVALENCIA.
5.1 Equipos y Procedimientos
Los ensayos de disolución deben realizarse en el aparato de paletas, (Aparato II.FA.7ma), a 75 rpm o en el aparato de canastillo (Aparato I.FA.7ma) a 100 rpm, en un volumen de 900 mL o menos, en los tres medios de disolución mencionados en 3.1.2.1. Los medios de disolución deben desgasificarse inmediatamente antes de comenzar el ensayo, filtrando cada medio al vacío y calentado previamente a 41°C, utilizando un filtro de membrana de 0,45 µm con agitación vigorosa. Puede emplearse otra metodología de desgasificado, adecuadamente validada.
Los equipos y procedimientos generales deberán estar de acuerdo con lo establecido en la Farmacopea Argentina o la USP edición vigente, así como con las siguientes recomendaciones:
a) No resulta admisible el comienzo escalonado del ensayo de disolución.
b) En el aparato de paletas, las unidades deben ser introducidas en cada vaso con el equipo detenido e inmediatamente después comenzar la agitación. En el aparato de canastillo, las muestras deben colocarse en los cestillos perfectamente secos, introducir los cestillos en los vasos, e inmediatamente después iniciar la agitación.
c) La extracción de las muestras puede realizarse en modo manual o automático. Si es manual, deberá usarse una jeringa con cánula de acero provisto de un filtro de tamaño de poro de entre 0.45 y 0.70 µm que puede estar ubicado en el extremo de la cánula o en su unión con la jeringa. Debe tenerse en cuenta la tolerancia máxima admitida en el tiempo de muestreo entre el primer vaso y el último. El rango admitido del tiempo de muestreo es ± 2% resultando, p. ej., para el muestreo a los 10 minutos (600 segundos), una diferencia entre el primer y último vaso de 12 segundos. Si no es posible la toma de muestra dentro de este margen de tolerancia, deberá usarse muestreo automático. En este caso deberá validarse la ausencia de interferencia del muestreo automático en los resultados.
d) No son admisibles para el filtrado de las muestras el filtrado por papel ni centrifugación.
Para calificar al equipo de disolución se recomienda realizar:
-Calibración mecánica: Con una antelación no mayor a seis meses de realizar los estudios comparativos de disolución, se recomienda verificar los siguientes parámetros críticos del equipo de disolución: horizontalidad, centrado y vaivén de los ejes, vaivén del canastillo, fluctuaciones de temperatura, velocidad de rotación de los ejes y altura del canastillo. Los límites aceptables son los establecidos en la USP vigente.
-Calibración química: Se recomienda emplear los comprimidos USP Prednisone tablets RS, ajustándose a las especificaciones establecidas para el lote vigente.
5.2 Validación del método analítico empleado en el estudio de disolución
Para que los resultados experimentales sean confiables, los métodos utilizados deberán ser apropiadamente validados. Se entiende por validación, al proceso mediante el cual se demuestra la aplicabilidad de un método analítico y consiste en el establecimiento de una evidencia documentada que demuestre con alto grado de probabilidad que el método es confiable para producir el resultado previsto dentro de los intervalos definidos. (19)
Los parámetros recomendados para la validación del método analítico utilizado son: linealidad, exactitud, precisión y robustez. Además se recomienda documentar la especificidad del método, la influencia del muestreo automático y del sistema de filtración de las muestras extraídas desde los vasos de disolución, la estabilidad del analito en las soluciones, la precisión intermedia y los límites de cuantificación y detección del analito. (19)
5.2.1 Especificidad
Es la capacidad de un método de cuantificar el analito en presencia de otros componentes que puedan estar presentes (impurezas, productos de degradación, aditivos). Para ello se recomienda:
• Pesar por triplicado muestras placebo (colorantes, excipientes, cápsulas vacías etc.), a concentración equivalente a la que contendría la dosis mayor y menor.
• Transferir la mezcla a vasos conteniendo medio de disolución a 37°C y agitar durante 1 hora a 150 rpm.
• Analizar las muestras.
• Calcular el porcentaje de interferencia a cada una de las concentraciones (n = 3), comparando con una solución estándar al 100% de la dosis.
La fórmula para calcular la interferencia en el método analítico es:
Donde:
I = Interferencia (en %)
C = Concentración de la solución estándar (mg/mL)
Ap y As = Absorbancia o Áreas del placebo y del estándar
V = Volumen de medio en el vaso (mL)
L = Dosis del producto, según rótulo (mg)
Especificación: La interferencia media no debe exceder el 2%
Si no se conoce la composición del placebo, se recomienda realizar la disolución de la formulación y analizarla. Luego, comparar la respuesta del compuesto a analizar contra una solución patrón o de referencia. Si el método es cromatográfico, se recomienda evaluar la interferencia de los picos en el tiempo de retención del analito.
5.2.2 Linealidad y Rango
Rango es el intervalo entre la concentración superior e inferior de concentración del analito en la muestra que ha demostrado que el método presenta un nivel adecuado de precisión, exactitud y linealidad. El rango de concentraciones se calcula de los estudios de linealidad.
• Si el método es espectrofotometría UV: determinar la longitud de onda máxima de absorción.
• Preparar una solución al 100% y determinar su respuesta (Absorbancia).
• Verificar si hay necesidad de diluir.
• Verificar que el medio no absorba a la misma longitud de onda.
• Si el método es por HPLC, se debe verificar que el medio no interfiera en el tiempo de retención del analito.
• Preparar una curva equivalente entre 10-120% de IFA disuelto.
Linealidad es la capacidad de un método analítico de asegurar que los resultados obtenidos son directamente proporcionales a la concentración del analito en la muestra. Para ello:
• Se prepara la curva de calibración.
• Se calculan el coeficiente de correlación, el intercepto, la pendiente y la suma de cuadrados residuales.
• El coeficiente de correlación no deberá ser menor a 0,98, el intercepto en “y” no debe ser diferente de 0, empleando un intervalo de confianza de 95%.
• El coeficiente de variación del factor de respuesta no debe ser mayor del 2%.
5.2.3 Exactitud
Expresa la cercanía entre el valor verdadero y el valor que es aceptado (sea como un valor convencional verdadero o un valor de referencia aceptado). La definición práctica indica que corresponde a la relación estrecha que existe entre la media aritmética obtenida de varios resultados analíticos en el procedimiento en estudio y el valor real o de referencia, lo cual está influenciado por errores sistemáticos como, por ejemplo, equipos de medición inadecuados, calidad incorrecta de los reactivos y método analítico inapropiado. Para ello se recomienda:
• Pesar el IFA (por triplicado) para obtener 3 concentraciones conocidas (incluyendo concentraciones mínima y máxima del intervalo).
• Añadir el IFA a vasos de disolución conteniendo el placebo.
• Analizar las muestras.
• Criterio: Una recuperación del 95-105% es aceptable. La desviación estándar relativa deberá ser =2%.
5.2.4 Precisión del método
Expresa la coincidencia (grado de dispersión) entre una serie de múltiples muestreos de una misma muestra homogénea, bajo condiciones establecidas. Corresponde al grado de concordancia de los datos obtenidos para una muestra procesada varias veces, lo que está limitado por errores aleatorios como los errores instrumentales e individuales, entre otros. Para ello se recomienda:
• Analizar réplicas de una solución estándar (n = 6).
• Calcular la desviación estándar relativa.
• Criterio: La desviación estándar relativa no deberá ser mayor al 2%.
5.2.5 Precisión Intermedia
Expresa la variación en los resultados observados cuando uno o más factores, tales como tiempo, equipamiento, operador, varían dentro de un mismo laboratorio. Dos analistas diferentes realizan dos estudios cinéticos de disolución (n=12) y se comparan los resultados promedio y los coeficientes de variación (%). La diferencia en los valores promedio, no debe exceder un 10% en aquellos tiempos en los que se ha disuelto = 85% y un 5% en los que se ha disuelto más del 85% del IFA en estudio.
5.2.6 Robustez
Se debe determinar durante la fase de desarrollo del método. Corresponde a una medida de la capacidad de un procedimiento analítico de entregar resultados analíticos con exactitud y precisión aceptables, frente a cambios pequeños, pero deliberados, en los parámetros del método (por ej., en un método espectrofotométrico, frente a pequeños cambios en la longitud de onda). Para ello, se recomienda realizar cambios pequeños, pero deliberados a las condiciones de disolución (n = 3). Dependiendo del método, los cambios pueden ser los siguientes:
• Soluciones reguladoras, modificar pH en 0,5 unidades arriba o abajo.
• HPLC: cambios de columna, flujo de la fase móvil, pH de la fase móvil, etc.
• Espectrofotometría UV: cambios en la longitud de onda ± 2 nm.
5.2.7 Estabilidad
Se debe asegurar la estabilidad de la solución estándar y de las muestras hasta el momento de su análisis. Para determinar la estabilidad de la solución estándar se recomienda almacenarla en condiciones que aseguren su estabilidad (por ej. en refrigeración), analizarla en el período de tiempo especificado y comparar el resultado con el obtenido con una solución estándar recientemente preparada. El rango de recuperación deberá estar entre 98-102% del valor promedio. Para el caso de las muestras se debe proceder de la misma forma. Vale decir, almacenar la solución en condiciones que aseguren su estabilidad, analizarla en el tiempo establecido y comparar el resultado con el obtenido inmediatamente de extraída la muestra desde el vaso de disolución. El porcentaje de recuperación deberá encontrarse entre 98-102% del valor promedio.
5.2.8 Interferencia del Filtro
Se analiza una solución de concentración conocida, luego se filtra y se mide nuevamente. Se comparan ambos resultados, siendo aceptable un rango de recuperación entre 98-102%.
5.2.9 Validación del muestreo automatizado
Se construyen dos perfiles de disolución con 6 unidades posológicas, muestreando simultáneamente de manera manual y automática, y se comparan los resultados obtenidos usando el criterio indicado en 5.2.5 Precisión Intermedia.
6. DOCUMENTACIÓN NECESARIA PARA RESPALDAR UNA SOLICITUD DE BIOEXENCIÓN
6.1 Solicitud de aprobación de Protocolo de Bioexención y Diseño de los estudios in vitro. Presentación de resultados
Previo a la realización de los estudios in vitro (solubilidad, permeabilidad y cinética de disolución), los interesados deberán presentar al INAME la solicitud de bioexención correspondiente.
Se deberán completar los siguientes anexos según el caso (ver al final de la presente guía):
-Anexo I: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en la Clasificación Biofarmacéutica”.
-Anexo II: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en formulaciones proporcionalmente similares”.
-Anexo III: “SOLICITUD DE BIOEXENCIÓN según DISPOSICIÓN ANMAT N° 556/09. Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado Bioequivalencia”.
En todos los casos, la ANMAT procederá a autorizar la realización de dichos estudios, si considera adecuada la información aportada. En caso de que la solicitud no corresponda, el trámite será denegado.
Las áreas involucradas en la evaluación de la solicitud de bioexención serán las responsables de otorgar la conformidad o de señalar los cambios que se estimen pertinentes en los protocolos de estudio. La ANMAT, autorizará al laboratorio Solicitante a llevar a cabo la demostración de equivalencia por metodología in vitro. En consecuencia, éstos sólo podrán realizarse una vez extendida la aprobación oficial de los protocolos por parte de la ANMAT.
Para presentar los resultados obtenidos se deberán completar los anexos correspondientes según el caso (ver al final de la presente guía):
-Anexo IV: “PRESENTACIÓN DE RESULTADOS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09. Bioexención basada en la Clasificación Biofarmacéutica”.
-Anexo V: “PRESENTACIÓN DE RESULTADOS DE PROPORCIONALIDAD DE DOSIS PARA SOLICITAR UNA BIOEXENCIÓN SEGUN DISPOSICIÓN ANMAT N° 758/09”.
-Anexo VI: “DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE CAMBIOS POSTERIORES A LA APROBACIÓN DE UN REGISTRO PARA SOLICITAR UNA BIOEXENCIÓN SEGUN DISPOSICIÓN ANMAT N° 556/09”.
Las áreas involucradas en la evaluación de los resultados serán las responsables de otorgar la conformidad o de requerir al laboratorio documentación, pruebas adicionales, o demostración de equivalencia in vivo, según corresponda.
En caso de resultar aceptable la información aportada en el trámite, la ANMAT aceptará la bioexención, mediante una Disposición aprobatoria.
6.2 Información sobre el laboratorio y el producto farmacéutico multifuente para el cual se solicita la bioexención
6.2.1 Datos del laboratorio solicitante
El interesado deberá completar los requisitos correspondientes del formulario de la solicitud de bioexención.
6.2.2 Requisitos sobre el producto multifuente en estudio
El interesado deberá completar los requisitos correspondientes del formulario de la solicitud de bioexención.
En los casos de formulaciones no registradas, la autorización para la realización de los estudios de bioexención no se efectivizará hasta que, las áreas técnicas correspondientes del ANMAT, hayan evaluado y aceptado la solicitud de registro. En los casos de formulaciones previamente registradas, deberá incluirse en la solicitud de bioexención el número de certificado correspondiente.
6.2.3 Establecimiento/s propuesto/s para realizar los estudios del Producto/s, y en caso de corresponder, de los IFA
Para cada uno de los ensayos de solubilidad, permeabilidad y cinética de disolución, ya sean realizados por el solicitante o tercerizados, se deberán completar los ítems mencionados en el formulario correspondiente.
6.2.4 Caracterización de elaboración y Buenas Prácticas de Fabricación y Control.
6.2.4.1 Caracterización de elaboración
Para el IFA en estudio se deberá presentar documentación que avale:
a) El cumplimiento de las especificaciones de calidad y consistencia en resultados obtenidos con los lotes propuestos para los estudios de bioequivalencia o equivalencia in vitro del producto multifuente.
b) Se deberá declarar la función que cumple cada excipiente en la formulación, dado que existe evidencia científica de que algunos excipientes pueden modificar la motilidad y/o permeabilidad del tracto gastrointestinal. De la misma forma, se deberá presentar un cuadro comparativo con la composición cuali/cuantitativa de los productos de referencia y multifuente, a los fines de establecer la adecuabilidad de los excipientes según ítem V Excipientes de la Disposición ANMAT N° 758/09.
6.2.4.2 Caracterización de Buenas Prácticas de Fabricación y Control
Para el IFA en estudio se deberá presentar documentación que avale que el proceso de elaboración ha sido validado y que la fabricación del producto se ha realizado siguiendo las Buenas Prácticas Fabricación y Control vigentes (Disposición ANMAT N° 2819/2004 o la/s que en el futuro la complemente o modifique).
6.3 Datos que respaldan la alta solubilidad del IFA
Se deberán presentar resultados respaldando la alta solubilidad del IFA detallando:
• Descripción del método analítico, la validación del mismo y composición de soluciones reguladoras.
• Información acerca del IFA, detallando estructura química, el peso molecular, naturaleza química (ácido, base, anfótero o neutro), constante de disociación y valores de los coeficientes de partición y distribución del mismo.
• Representación gráfica de los resultados de solubilidad en un gráfico solubilidad vs pH.
• Resultados individuales de solubilidad, indicando el pH de la solución empleada, expresados en unidades de concentración (mg/mL) y el volumen del medio requerido para disolver la mayor concentración posológica. Resultados promedios. Desviación estándar.
6.4 Datos que respaldan la alta permeabilidad del IFA en caso de que no esté en el listado de la OMS
Se deberán presentar resultados propios y antecedentes científicos válidos que avalen la permeabilidad del IFA utilizado en la elaboración del producto farmacéutico.
En la solicitud, se deberá incluir la siguiente información:
- En caso de utilizar métodos de permeabilidad en humanos, se debe aportar información acerca del diseño del estudio y de los métodos farmacocinéticos, analíticos y bioestadísticos utilizados, junto con los datos farmacocinéticos “crudos” del estudio. De acuerdo con los requisitos enumerados en: Disposiciones ANMAT N° 6677/10, 3185/99, 3598/02, 5040/06 y la/s que en el futuro la/s modifiquen o complementen.
- En caso de utilizar métodos de permeabilidad alternativos, se debe presentar descripción del método de estudio de permeabilidad a emplear, criterios de selección de animales o línea celular, concentraciones del IFA a emplear en fluido donante e informe de validación del método analítico.
Se debe entregar en detalle el listado de IFAS modelo utilizados para la Validación del método de estudio de la permeabilidad, los valores de permeabilidad (promedio, desviación estándar y CV%), y un gráfico de fracción absorbida en humanos en función de la permeabilidad, identificando el límite de permeabilidad alta/baja y el patrón interno seleccionado para este fin. El número de IFAS modelo deberá ser quince (15). Esta lista deberá incluir IFAS de permeabilidad alta, moderada y baja, además de un IFA punto de corte (p. ej., metoprolol) incluyendo en todos los casos su respectiva clasificación biofarmacéutica.
6.5 Datos que respaldan la cinética de disolución
En el trámite de solicitud de bioexención de un producto, deberán presentar información sobre las características del equipo de disolución utilizado (marca, equipo, calibración, etc).
Por otro lado, basado en el SCB del IFA, se deberá presentar información que respalde las características de rápida o muy rápida disolución (punto 3.1.2 de este documento).
6.6 Evaluación de la solicitud de bioexención
En caso de resultar aceptable la información aportada en el trámite y la/las metodología/s propuesta/s para los ensayos correspondientes, la ANMAT aceptará la solicitud de bioexención, que autorizará al laboratorio solicitante a llevar a cabo la demostración de equivalencia por metodología in vitro.
Si la solicitud de bioexención es objetada, la ANMAT requerirá al laboratorio documentación, pruebas adicionales o demostración de equivalencia in vivo, según corresponda.
6.7 Verificación técnica
En caso de tratarse de un producto aún no comercializado, corresponderá realizar la verificación técnica de acuerdo a la Disposición ANMAT N° 5743/09.
El laboratorio deberá comunicar fehacientemente con 30 días de anticipación el inicio de los estudios de cinética comparativa de disolución. El personal técnico de la ANMAT podrá presenciar o de ser necesario, repetir o hacer repetir parcial o totalmente el estudio comparativo. En caso de realizar los ensayos de solubilidad y permeabilidad, se deberá comunicar con el mismo lapso de tiempo, el período en el cual se realizarán dichos ensayos.
6.8 Retención de Contramuestras
Se deberán mantener tres contramuestras de los lotes de los productos de referencia y multifuente utilizados en los ensayos, durante 2 años y 6 meses desde el momento de la aprobación del estudio, respetando las condiciones de almacenamiento indicadas en el rotulado. Cada contramuestra deberá contener al menos 60 unidades de cada producto.
6.9 Presentación de resultados
Los resultados de los estudios de solubilidad, permeabilidad y del estudio de cinética de disolución comparativa deberán presentarse de acuerdo a los formularios correspondientes, independientemente de si el personal técnico de la ANMAT hubiera o no presenciado los estudios.
Los resultados obtenidos en los estudios comparativos deberán informarse de acuerdo a la solicitud aprobada, completando en cada caso la tabla que corresponda en el Anexo VII: “GUÍA DE BIOEXENCIONES. RESULTADOS DE LOS ESTUDIOS DE DISOLUCIÓN”. Se indicará el porcentaje de IFA disuelto en cada intervalo de prueba, para cada unidad posológica individual, consignándose el porcentaje promedio de IFA disuelto, el rango (mayor y menor) de disolución y el coeficiente de variación (desviación estándar relativa).
En la comparación de los productos multifuente (M) y referencia (R), se deberá confrontar los perfiles cinéticos de disolución usando el factor de similitud (f2); cuando esta metodología no fuese adecuada pueden aplicarse metodologías estadísticas alternativas siempre que las mismas sean válidas y justificadas satisfactoriamente. El factor de similitud corresponde a la transformación logarítmica de la raíz cuadrada recíproca de la suma del error cuadrado y proporciona una estimación de la similitud en las cinéticas de disolución entre ambos productos.
Los dos perfiles se consideran similares cuando el valor de f2 es = 50.
Para permitir el uso de datos promedio, el coeficiente de variación no deberá ser más del 20% en los puntos temporales más tempranos del perfil de disolución (p.ej., 5 o 10 minutos), y no más del 10% en los demás puntos temporales del perfil.
Para el cálculo de f2 se requiere un mínimo de tres puntos temporales (excluir el cero y tomar un solo punto temporal en el que el valor de disolución para el producto de referencia sea igual o mayor al 85%). Un valor de f2 de 50 o mayor (50-100) refleja la equivalencia de las dos curvas.
Cuando el IFA contenido tanto en el producto de referencia como en el producto multifuente en estudio, se disuelve en un porcentaje de 85% o más de la cantidad declarada del IFA a los 15 minutos o menos, utilizando los medios de disolución que correspondan, la disolución de los productos es considerada equivalente y no es necesaria la comparación de perfiles.
6.10 Aceptación o rechazo de la Equivalencia
6.10.1 Bioexención basada en el SCB del IFA
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto presentado respecto al producto de referencia.
6.10.2 Bioexención por formulaciones proporcionalmente similares
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto presentado respecto al de referencia (diferente dosis del mismo producto con equivalencia aceptada).
6.10.3 Bioexención por cambios post aprobatorios según Disposición ANMAT N° 556/09
La ANMAT se expedirá sobre la aceptación o rechazo de la equivalencia del producto con los cambios propuestos respecto al producto con equivalencia demostrada.
7. CÓMO TRAMITAR UNA BIOEXENCIÓN
7.1 Protocolo del estudio
Se deberá completar el Formulario de Solicitud de Bioexención correspondiente (Anexos I-III). La información solicitada, se presentará en Mesa de Entradas del INAME.
Evaluada la información por las áreas pertinentes, la aceptación del trámite de solicitud se hará mediante nota aprobatoria de la Dirección Nacional.
7.2 Resultados del estudio
Con el protocolo de solicitud aprobado, una vez terminado el estudio, se deberá completar el Formulario de Presentación de Resultados para una Bioexención (Anexos IV-VII) acompañado con la documentación correspondiente. Esta información deberá ser presentada en Mesa de Entradas INAME para ser incorporada al expediente de Bioexención.
7.3 Certificación de un producto como Equivalente
Frente a la demostración de equivalencia entre el producto multifuente y el producto comparador de referencia, la ANMAT procederá a dictar la disposición correspondiente declarando al producto multifuente PRODUCTO EQUIVALENTE al producto de referencia.
8. DISPOSICIONES ANMAT RELACIONADAS CON LA PRESENTE GUÍA
-5904/96
Definiciones y lineamientos generales acerca del modo en que deberá incluirse la información que deben contener los prospectos de especialidades medicinales cuya condición de expendio sea la de venta bajo receta en sus tres categorías.
-3185/99
Apruébanse las recomendaciones técnicas contenidas en el documento “cronograma para exigencias de estudios de equivalencia entre medicamentos de riesgo sanitario significativo”.
-3311/01
Establécense las condiciones en las cuales deberán realizarse los estudios, de bioequivalencia/biodisponibilidad de las especialidades medicinales que contengan como principio activo individual uno de los antirretrovirales utilizados para el tratamiento de la infección con el virus de la inmunodeficiencia humana, tanto para las actualmente en comercialización, como las registradas y no comercializadas.
-2807/02
Incorporación de a la droga Isotretinoína al cronograma de bioequivalencia. Selección de productos comparadores para estudios de bioequivalencia, para las drogas Carbamazepina, Oxcarbazepina, Valproato, Ciclosporina, Teofilina, Verapamilo, Digoxina e Isotretinoína.
-2819/04
Apruébense los lineamientos generales de Buenas Prácticas de Fabricación para Elaboradores, Importadores/Exportadores de Medicamentos.
-5040/06
Apruébase el Régimen de Buenas Prácticas para la Realización de Estudios de Biodisponibilidad/Bioequivalencia.
-1746/07
Sustitúyese el Anexo I de la Disposición N° 5040/2006, referido al Régimen de Buenas Prácticas para la Realización de Estudios de Biodisponibilidad/Bioequivalencia.
-2446/07
Incorpóranse determinados principios activos (Serolimus, Everolimus, Tacrolimus y Micofenolato) a la exigencia de realización de estudios de Bioequivalencia/Biodisponibilidad, establecidos por la Disposición N° 3185/99.
-556/09
Apruébase la Guía para aplicar en los Cambios de Escala y Cambios Posteriores al Registro de Medicamentos Sujetos a Demostración de Bioequivalencia.
-758/09
Criterios de Bioexención de Estudios de Bioequivalencia para Medicamentos sólidos orales de liberación inmediata.
-5743/09
La evaluación de la información relacionada con los métodos de control, elaboración, ensayos farmacotécnicos, estudios de estabilidad, capacidad operativa para elaborar y/o de control incluida en las solicitudes de inscripción en el registro de especialidades medicinales, se realizara mediante la verificación técnica de dicha información, debiendo cumplimentarse los requisitos establecidos en la Disposición ANMAT N° 2819/2004 o la que en el futuro la reemplace y las especificaciones de calidad establecidas en la farmacopea argentina, farmacopea brasileña y/u otra farmacopea internacionalmente reconocida.
-6677/10
Apruébase el Régimen de Buena Práctica Clínica para Estudios de Farmacología Clínica.
-3113/10
Incorpóranse a la exigencia de realización de estudios de Bioequivalencia / Biodisponibilidad, establecidos por la Disposición (ANMAT) N° 3185/99, a los ingredientes farmacéuticos activos Lamotrigina y Topiramato
-1263/12
Establécese que, a los fines de la realización del estudio de bioequivalencia o equivalencia “in vitro”, según corresponda, el laboratorio patrocinante deberá proponer alguna de las tres opciones siguientes: a) tres lotes vigentes, de escala industrial, idénticos al producto a comercializarse, b) tres lotes pilotos de tamaño no menor a las 100.000 unidades o c) tres lotes pilotos sin establecer un tamaño mínimo de unidades; las opciones b) o c) solo serán aceptables siempre que los lotes se elaboren en equipos de escala industrial que se encuentren calificados para ese tamaño de lote y que sean idénticos en capacidad y principio de funcionamiento a los que se emplearan para producir los lotes a comercializar.
-4132/12
Exigencia de demostración de bioequivalencia establecida en la Disposición ANMAT N° 3185/99, a todas las concentraciones comercializadas y/o a comercializarse de una especialidad medicinal, de forma farmacéutica sólida oral, que contenga alguno de los Ingredientes Farmacéuticos Activos incluidos en la normativa nacional sobre estudios de bioequivalencia y en disposiciones complementarias posteriores de exigencia de bioequivalencia.
-4326/12
Adóptanse como criterios de riesgo sanitario, para la inclusión de ingredientes farmacéuticos activos en el cronograma de exigencia de estudios de bioequivalencia in-vivo, a los obrantes en el Anexo I de la presente disposición.
-4788/12
Incorpóranse a las exigencias de realización de estudios de Bioequivalencia/Biodisponibilidad, establecidas por Disposición (ANMAT) N° 3185/99, a los ingredientes farmacéuticos activos que figuran en el Anexo I de la presente disposición, que forma parte integrante de la misma.
-1918/13
Establécense los criterios para la selección de una especialidad medicinal como producto de referencia para los estudios de Bioequivalencia y Equivalencia In-Vitro que figuran en el Anexo I de la presente disposición, que forma parte integrante de la misma.
-2434/13
Establécese que los titulares de laboratorios de especialidades medicinales que contengan IFAS, respecto de los cuales esta Administración Nacional exige la realización de estudios de Bioequivalencia, que soliciten la aprobación de resultados de estudios realizados en el exterior, deberán cumplir con los requisitos que se detallan en el Anexo I de la presente Disposición.
9. REFERENCIAS
1- Amidon G. L., Lennernäs H., Shah V. P. and Crison J. R. A. Theoretical Basis for a Biopharmaceutics Drug Classification: The Correlation of In vitro Drug Product Dissolution and In vivo Bioavailability. Pharmaceutical Research,12(3):413-420, 1995.
2- FDA, 1997. Guidance for Industry: Dissolution Testing of Immediate Release Solid Oral Dosage Forms, US Center for Drug Evaluation and Research, USA.
3- Fan de Waterbeend H. Fundamental Variables of the Biopharmaceutics Classification System (BCS: A Commentary). European Journal of Pharmaceutical Sciences, Vol 7: 1-3, 1998.
4- Chenga C-L., Yub L. X., Leec H-L., Yangd C-Y., Luee C-S., Chen C-H. Biowaiver extension potential to BCS Class III high solubility-low permeability drugs: bridging evidence for metformin immediate-release tablet. European Journal Pharmaceutical Scinces,22, 297-304, 2004.
5- Lindenberg M., Koop S. and Dressman J.B. Classification of. orally administered drugs on the World Health Organization Model list of Essential Medicines according to the biopharmaceutics classification system. Eur. J. Pharm. Biopharm., 58, 265 - 278, 2004.
6- Polli J. E., Yu L. X., Cook J. A., Amidon G. L., Borchardt R. T., Burnside B. A., Burton P. S., Chen M. L. Conner D. P., Faustino P. J., Hawi A. A., Hussain A. S. Joshi H. N., Kwei Lee V. H. Lesko L. J., Lipper R. A., Loper A. E., Nerurkar S., Polli J. W., Sanvordeker D. R., Taneja R. Uppoor R. S., Vattikonda C. S., Wilding I., Zhang G. Summary Workshop Report: Biopharmaceutic Classification System-Implementation Challenges and Extension Opportunities. J. Pharm. Sci., 93 (6), 1375 - 1381, 2004.
7- FDA, 2000. Guidance for industry: Waiver of In vivo Bioavailability and Bioequivalence Studies for Immediate Release Solid Oral Dosage Forms based on Biopharmaceutics Classification System. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
8- Yu L.X., Amidon G., Polli J., Zhao H., Mehta M., Conner D., Shah V., Lesko L., Chen M, Lee V. and Hussain A. Biopharmaceutics Classification System: The Scientific Basis for Biowaiver Extensions, Pharml Res., 19(7):921-5, 2002.
9- Bermejo M. and Amidon G. “Bioequivalencia In Vitro. ¿Porqué, cuando y cómo Aplicación del BCS (Sistema de Clasificación Biofarmacéutico). En: Primer Encuentro Iberolatinoamericano de Academias de Farmacia. Valparaíso Chile, Abril 2005.
10- Yazdanian N., Briggs K., Jankosky C. and Hawi A. The “High Solubility” definition on the current FDA Guidance on Biopharmaceutical Classification System may be too strict for acidic drugs. Pharml Res, 21(2): 293-299, 2004.
11- Le Cluyse E. and Sutton, S. In vitro models for selection of development candidates. Permeability Studies to defined mechanisms of absorption enhancement. Adv. Drug Del. Rey., 23:163-183, 1997.
12- Farmacopea Nacional Argentina. Séptima edición.
13- USP 38. United States Pharmacopeia
14- FDA, 1987. Guideline on General Principles of Process Validation. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
15- ANVISA. Dispõe sobre o Guia para isençáo e substituição de estudos de biodisponibilidade relativa/bioequivalência e dá outras providências. RESOLUÇÃO. RDC N° 37, 3 DE AGOSTO DE 2011.
16- Instituto de Salud Pública de Chile, 2007. Guía Técnica G-BIOF 02: Bioexención de los estudios de Biodisponibilidad/Bioequivalencia para establecer Equivalencia Terapéutica de Formas Farmacéuticas Sólidas Orales. Sección de Biofarmacia.
17- FDA, 2000. Formas posológicas orales sólidas de liberación inmediata Cambios de escala y posteriores a la aprobación: documentación química, de fabricación y controles, de pruebas de disolución in vitro y bioequivalencia in vivo. US Food and Drug Administration, Center for Drug Evaluation and Research, USA.
18- Health Canada. Release of Guidance Document: Biopharmaceutics Classification System Based Biowaiver. May 30, 2014; File number: 14-105447-315.
19- European Medicines Agency (EMA), Guideline on the Investigation of Bioequivalence. London, 20 January 2010.
20- WHO technical report series. WHO Expert Committee on Specifications for PharmaceuticaI Preparations. Forty-nineth report. Geneva, World Health Organization, 2015 (WHO Technical Report Series, No. 992): 131.
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo I: Bioexención basada en la Clasificación Biofarmacéutica.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación
| Condiciones de disolución | |
| Equipo | |
| RPM | |
| Medio | |
| Volumen | |
| Temperatura | |
| Enzimas | |
| Volumen de muestra | |
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo II: Bioexenciones basadas en formulaciones proporcionalmente similares.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación
Tabla 1: Datos de disolución in vitro para la Bioexención requerida
| Condiciones de disolución | |
| Equipo | |
| RPM | |
| Medio | |
| Volumen | |
| Temperatura | |
| Enzimas | |
| Volumen de muestra | |
DOCUMENTACIÓN REQUERIDA PARA LA SOLICITUD DE BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 556/09
Anexo III: Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado bioequivalencia o equivalencia in vitro basado en la clasificación biofarmacéutica.
SOLICITANTE:
OBJETIVO DEL ESTUDIO:
Índice de la Presentación
Tabla 1: Datos de disolución in vitro para la Bioexención requerida.
| Condiciones de disolución | |
| Equipo | |
| RPM | |
| Medio | |
| Volumen | |
| Temperatura | |
| Enzimas | |
| Volumen de muestra | |
DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09.
Anexo IV: Bioexención basada en la Clasificación Biofarmacéutica
INFORMACIÓN - DOCUMENTO
DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE PROPORCIONALIDAD DE DOSIS PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 758/09
Anexo V: Bioexenciones basadas en formulaciones proporcionalmente similares
INFORMACIÓN - DOCUMENTO
DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE CAMBIOS POSTERIORES A LA APROBACIÓN DE UN REGISTRO PARA SOLICITAR UNA BIOEXENCIÓN SEGÚN DISPOSICIÓN ANMAT N° 556/09
Anexo VI: Cambios posteriores a la aprobación del registro de un producto farmacéutico que ha demostrado Bioequivalencia o equivalencia in vitro
INFORMACIÓN - DOCUMENTO
DOCUMENTACIÓN REQUERIDA PARA LA PRESENTACIÓN DE RESULTADOS DE ESTUDIOS DE CINETICA DE DISOLUCIÓN
Anexo VII: Planillas para la presentación de los resultados individuales de los estudios de cinética de disolución.
Planillas modelo para completar con los resultados de los estudios cinéticos para ambos productos en cada uno de los medios requeridos. Se deberá presentar una planilla para cada producto en cada medio utilizado por separado.
Las planillas contienen datos mínimos a ser presentados de los estudios cinéticos y deberán estar acompañadas de los datos crudos. Asimismo cualquier información adicional podrá ser adjuntada en este anexo.
e. 30/06/2016 N° 45766/16 v. 30/06/2016